Physique-Chimie Cycle 4
Nouveau manuel de Sciences et Technologie 6e
Découvrez cet ouvrage collaboratif, conforme au nouveau programme !
Mes Pages
Thème 1 - Organisation et transformations de la matière
Ch. 1
L'eau que nous buvons est-elle pure ?
Ch. 2
La matière : états, masse et volume
Ch. 3
Les changements d'état de la matière
Ch. 4
Les mélanges
Ch. 5
La matière à l'échelle microscopique
Ch. 6
Que trouve-t-on dans l'air ?
Ch. 7
Les transformations chimiques et la pollution
Ch. 8
Modélisation des transformations chimiques
Ch. 9
Les ions dans notre quotidien
Ch. 10
Quand les acides et les bases réagissent
Ch. 11
Introduction à la masse volumique
Ch. 12
La masse volumique
Ch. 13
La matière, dans l'espace et dans l'Univers
Ch. 14
De l'Univers aux atomes
Thème 2 - Mouvement et interactions
Ch. 15
Introduction à la vitesse et au mouvement
Ch. 16
Repérage de mouvement et mesure de vitesse
Ch. 17
Vitesse et mouvement
Ch. 18
Les interactions
Ch. 19
Les forces
Ch. 20
Le poids
Thème 3 - L'énergie et ses conversions
Ch. 21
Introduire la notion d'énergie
Ch. 22
Conversion et transfert de l'énergie
Ch. 23
La conservation de l'énergie
Ch. 24
Les circuits électriques
Ch. 25
La tension et l'intensité
Ch. 26
Relations entre grandeurs dans les circuits électriques
Ch. 27
Résistance et loi d'Ohm
Ch. 28
Puissance et énergie en électricité
Thème 4 - Des signaux pour observer et communiquer
Ch. 29
Le son
Ch. 30
La lumière
Ch. 31
Vitesse de propagation des signaux
Ch. 32
Des signaux au-delà de la perception humaine
Chapitre 4
Bilan
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Compétence : Travailler en autonomie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
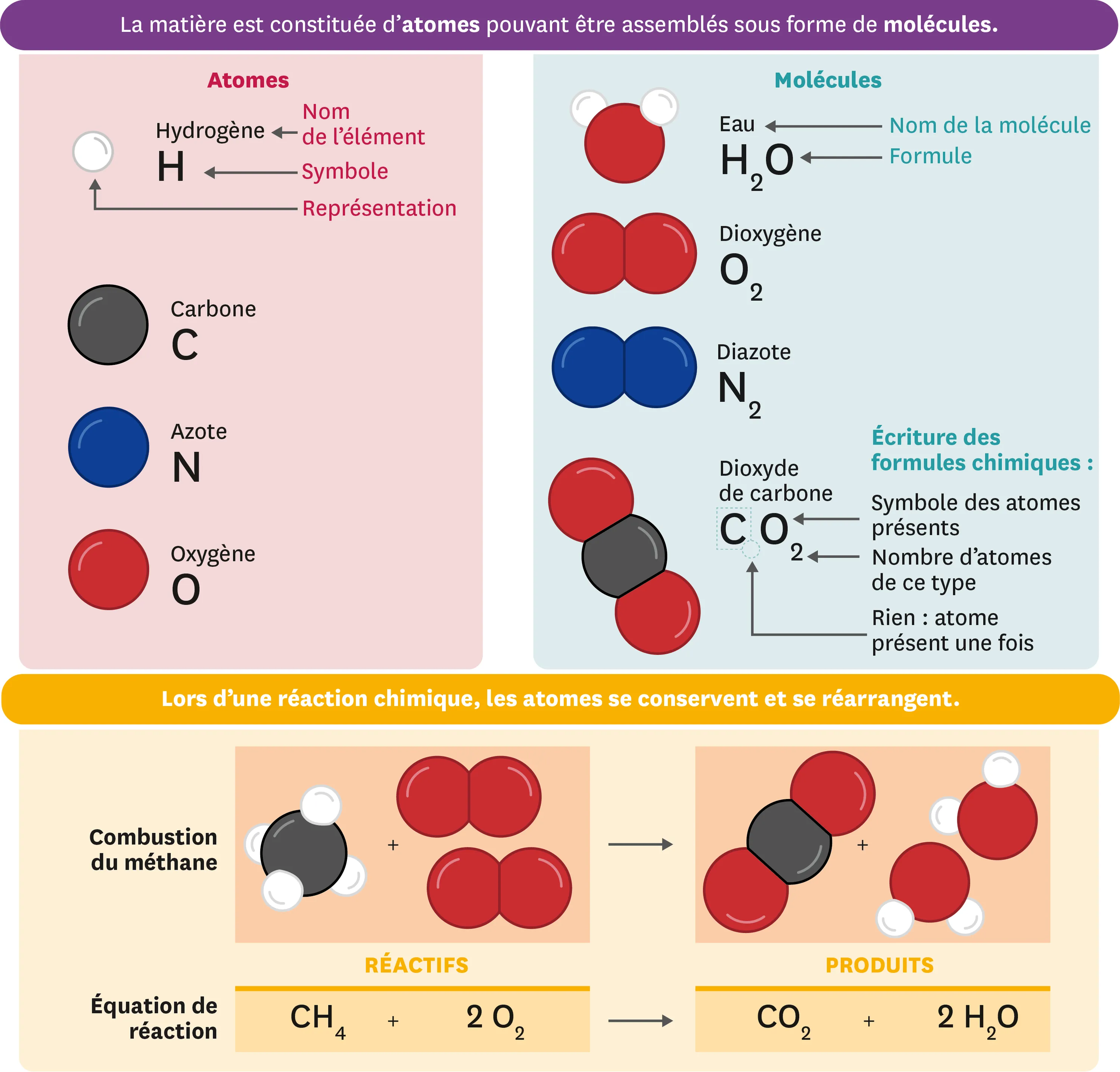
1Les atomes
- Les atomes sont les constituants de base des molécules.
- À chaque type d'atome, on associe un symbole chimique : une lettre majuscule éventuellement suivie d'une lettre minuscule.
- Les 118 types d'atomes connus sont rassemblés dans un tableau.
- Décrits de manière simplifiée, les atomes sont de très petites sphères. On utilise souvent des sphères en plastique ou dessinées pour les représenter.
Le saviez-vous ?
Les particules de matière les plus simples s'appellent des atomes et s'assemblent pour former des molécules. Chaque atome possède un nom et un symbole.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Les représentations des molécules
Le saviez-vous ?
La formule chimique d'une molécule indique les atomes dont elle est composée. Les éventuels nombres en indice précisent combien de fois les atomes concernés sont présents.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Interpréter les transformations chimiques
- Au cours d'une transformation chimique, les atomes composant les molécules des réactifs se réarrangent pour former les molécules des produits. Les molécules de réactifs sont donc détruites mais pas leurs atomes.
- Une transformation chimique est modélisée par une réaction chimique, qui ne détaille que l'état initial et l'état final.
- L'équation de la réaction est un bilan dans lequel les molécules sont notées avec leur formule chimique.
Le saviez-vous ?
Une transformation chimique est un réarrangement d'atomes qui entraine la disparition des réactifs en même temps que l'apparition des produits. On symbolise ce processus avec une équation de réaction. Par ex. : C + O2 -> CO2
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4La conservation des atomes
- Au cours d'une transformation chimique, aucun atome n'est créé ni détruit. On dit qu'il y a conservation des atomes.
- Une équation de réaction équilibrée exprime la conservation des atomes : il y a le même nombre d'atomes dans les réactifs et les produits.
- Dans une équation de réaction équilibrée, on a ajusté le nombre des molécules (réactifs et/ou produits) concernées par la réaction, sans modifier leur formule.
Le saviez-vous ?
Une équation de réaction est équilibrée si elle montre que les atomes sont conservés au cours de la transformation chimique.
Par ex. : CH4 + 2 02 -> CO2 + 2 H20
Par ex. : CH4 + 2 02 -> CO2 + 2 H20
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Un atome : activité 1.
- Une équation de réaction : activité 3 et 4.
- Une équation équilibrée : activité 4.
- Une molécule : activité 1 et 2.
- Une réaction chimique : activité 3.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je retiens par l'image

Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
