Chapitre 2
Exercices
Pour s'entraîner
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Le plein de vitamine C
✔ VAL : Appliquer une relation entre des grandeurs physiques
✔ MATH : Identifier une relation de proportionnalité
Un comprimé de vitamine C contient 1 000 mg d'acide ascorbique. Il se prend dans un verre d'eau de 20 cL.


1. Une orange contient 115 mg d'acide ascorbique. Combien faut-il d'oranges pour obtenir la même masse d'acide ascorbique que le comprimé ?
2. Il faut environ trois oranges pour obtenir 200 mL de jus. Quelle est la concentration en acide ascorbique du jus d'orange ?
2. Il faut environ trois oranges pour obtenir 200 mL de jus. Quelle est la concentration en acide ascorbique du jus d'orange ?
3. Quel volume de la solution obtenue avec le comprimé
dans le verre contient la même masse d'acide ascorbique que ces trois oranges ?
4. Quel volume d'eau faut-il ajouter au verre contenant le comprimé pour obtenir la même concentration en acide ascorbique que le jus d'orange ?
4. Quel volume d'eau faut-il ajouter au verre contenant le comprimé pour obtenir la même concentration en acide ascorbique que le jus d'orange ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Doses homéopathiques en QCM
✔ VAL : Appliquer une relation entre des grandeurs physiques
En homéopathie, les concentrations s'expriment en CH. En réalité, c'est plutôt le facteur de dilution F qui s'exprime en CH. 1 CH correspond à un facteur de dilution de 100. On a : F = \text{a} CH = 102a.

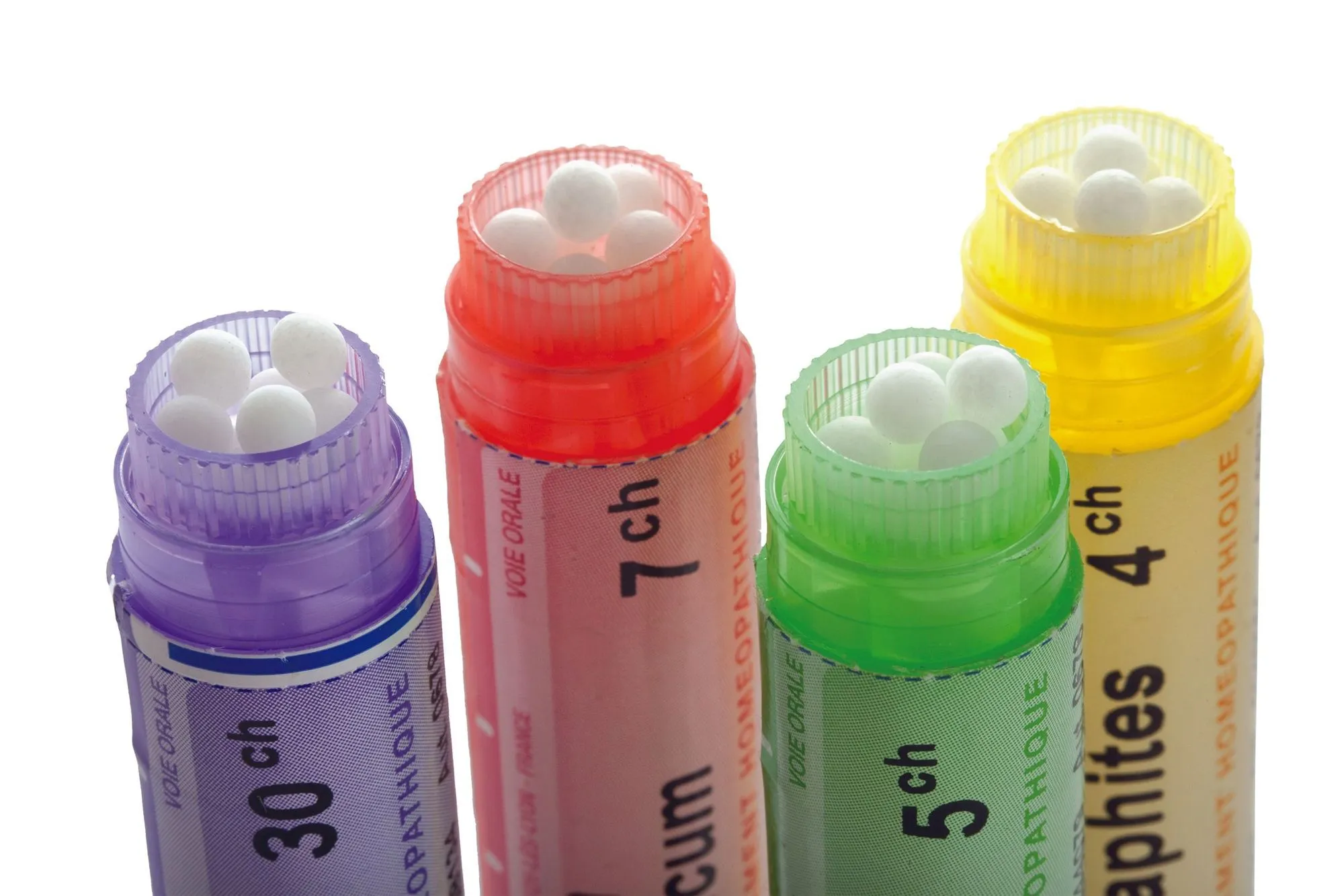
1. Quel est le facteur de dilution pour des granules 1 CH ?
2. Parmi les préparations suivantes, quelle est la plus concentrée ?
2. Parmi les préparations suivantes, quelle est la plus concentrée ?
3. Quel volume de solvant faut-il ajouter à un volume de
de granules à 1 CH pour obtenir des granules à 3 CH ?
4. Un échantillon contient en moyenne N = 1022 entités. Après dilution à 16 CH, le nombre d'entités est :
4. Un échantillon contient en moyenne N = 1022 entités. Après dilution à 16 CH, le nombre d'entités est :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23De l'or dans l'eau de mer
✔ VAL : Appliquer une relation entre des grandeurs physiques
✔ COM : Associer les bonnes unités aux grandeurs physiques
L'eau de mer contient de nombreux éléments chimiques en quantités infimes. Par exemple, la concentration en or est de l'ordre de 5,0 \times 10-12 kg·L-1.
1. Quelle est la masse d'or contenue dans 1 m3 d'eau de mer ?
2. Quel volume d'eau de mer faudrait-il pour fabriquer une bague de 3,5 g en or jaune ?
L'or
La législation française de 1994 n'autorise l'appellation « Or » que pour les alliages dont le titre est d'au moins 750/1 000. Ceci signifie que dans 1 000 g d'alliage (1 kg de métal), il y a toujours au moins 750 g d'or fin (ou pur). Le reste est constitué de différents métaux purs comme dans les exemples suivants :
- l'or vert comprend 250 ‰ d'argent ;
- l'or blanc peut comprendre, par exemple, 250 ‰ de palladium ou bien 250 ‰ de nickel ;
- l'or jaune comprend 125 ‰ d'argent et 125 ‰ de cuivre ;
- l'or rose comprend 90 ‰ d'argent et 160 ‰ de cuivre (la composition peut varier) ;
- l'or violet comprend 250 ‰ d'aluminium.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24
Comprendre les attendus
Pour bien respirer
✔ APP : Maîtriser le vocabulaire✔ ANA : Choisir un protocole
Pour soigner les problèmes respiratoires, un pharmacien conseille de mélanger 10 mL d'huile essentielle d'eucalyptus, 5,0 mL d'huile essentielle de thym et de compléter à 100 mL avec de l'huile végétale.
1. Identifier le solvant dans cette situation.
2. Indiquer un protocole pour réaliser ce mélange avec précision.
3. Quelle est la concentration (en g/L) en huile de thym ?


2. Indiquer un protocole pour réaliser ce mélange avec précision.
3. Quelle est la concentration (en g/L) en huile de thym ?


Données
Détails du barème
TOTAL /5 pts
1 pt
1 Savoir identifier un solvant.1 pt
2 Choisir la verrerie adaptée.1 pt
2 Proposer un protocole cohérent.1 pt
3 Déterminer les formules utiles.1 pt
3 Appliquer les formules avec les bonnes unités.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25Précision d'une préparation
✔ VAL : Précision et incertitudes
✔ VAL : Appliquer une relation entre des grandeurs
On prépare une solution aqueuse de sulfate de fer en dissolvant 0,50 g de sulfate de fer avec de l'eau dans une fiole de 100,0 mL. La balance utilisée est précise à ± 0,01 g. Le volume de la fiole est garanti à ± 0,2 mL. L'incertitude sur la concentration est donnée par la relation suivante :
U(\gamma)=\gamma \sqrt{\left(\dfrac{U(m)}{m}\right)^{2}+\left(\dfrac{U(V)}{V}\right)^{2}}
1. Quelle est la concentration \gamma de la solution fabriquée ?
2. Calculer l'incertitude sur la concentration attendue.
3. Si on choisit maintenant de faire la même solution avec une fiole de (200,0 ± 0,2) mL et 1,00 g de solide, que devient l'incertitude sur la concentration attendue ? Commenter le résultat.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Précision d'une dilution
✔ VAL : Précision et incertitudes
✔ VAL : Appliquer une relation entre des grandeurs
On souhaite diluer 20 fois une solution commerciale de soude (hydroxyde de sodium) à (10 ± 1) g·L-1 . On dispose d'une fiole jaugée de (200,0 ± 0,2) mL et d'une pipette de (10 ± 0,04) mL. L'incertitude sur la concentration de la solution fille U (\gamma_{\text { fille}}) est donnée par la relation suivante :
U \left(\gamma_{\text { fille}}\right)=\gamma_{\text { fille}} \sqrt{\left(\dfrac{U\left(\gamma_{\text { mère}}\right)}{\gamma_{\text{ mère}}}\right)^{2}+\left(\dfrac{U\left(\text {V}_{\text {mère}}\right)}{\text {V}_{\text {mère}}}\right)^{2}+\left(\dfrac{U\left(\text {V}_{\text {fille}}\right)}{\text {V}_{\text {fille}}}\right)^{2}}
1. Calculer l'incertitude sur la concentration de la solution diluée finale.
2. Donner un encadrement de cette concentration.
2. Donner un encadrement de cette concentration.


Dépôt de natron au fond du cratère Emi Koussi, Tchad. La soude est issue du natron dont le sodium tire son symbole chimique \text{Na}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Utiliser une échelle de teintes
✔ REA : Effectuer des mesures
Le bleu patenté est un colorant alimentaire (E131). Pour connaître la masse contenue dans un bonbon Schtroumpf, on réalise une échelle de teintes aux concentrations : 1\times10-3 g·L-1, 2\times10-3 g·L-1, 3\times10-3 g·L-1 et 4\times10-3 g·L-1 (dans les quatre premiers tubes à essai ci-après). Puis on dissout la partie bleue du bonbon dans 40 mL d'eau chaude. On obtient la solution du 5e tube.


1. Donner un encadrement de la concentration en E131 dans le 5e tube.
2. En déduire un encadrement de la masse de colorant dans un bonbon.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Gel hydroalcoolique
✔ APP : Maîtriser le vocabulaire du cours
✔ VAL : Appliquer une relation entre des grandeurs physiques
1. Identifier le solvant dans la composition du gel
hydroalcoolique.
2. Quelle masse d'éthanol à 96 % est utilisée pour 10 L de solution ?
3. Déterminer la masse volumique (en g/L) du gel.
2. Quelle masse d'éthanol à 96 % est utilisée pour 10 L de solution ?
3. Déterminer la masse volumique (en g/L) du gel.
Données
Le gel hydroalcoolique
La formule de la solution hydroalcoolique développée par D. Pittet est mise à disposition par l'Organisation mondiale de la santé. Le mélange de liquides est le suivant (pour 10 L finaux) : 8,333 L d'éthanol à 96 %, 417 mL de solution de peroxyde d'hydrogène à 3 %, 174 g de glycérol à 98 % et le reste est complété avec de l'eau distillée.
Ressource affichée de l'autre c�ôté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29Copie d'élève à commenter
Proposer une justification pour chaque erreur relevée par le correcteur. Les réponses sont liées à des questions indépendantes.
1. La concentration C est donc de : \gamma=2,7 \times 10^{-1} mg/L-1.
2. Lors d'une dilution, le facteur de dilution vaut : F = \color{red}\xcancel{\color{black}\gamma_{\text { mère }}/\gamma_{\text { fille }} = V_{\text { mère }}/ V_{\text { fille }}}
F s'exprime en L.
3. Pour prélever 10 mL lors cette dilution, il est préférable d'utiliserune éprouvette graduée de 10 mL.
4. Pour préparer une solution de sel de concentration 9 g/L,il suffit de prendre 1 L d'eau précisément et d'y ajouter 9 g de sel.
2. Lors d'une dilution, le facteur de dilution vaut : F = \color{red}\xcancel{\color{black}\gamma_{\text { mère }}/\gamma_{\text { fille }} = V_{\text { mère }}/ V_{\text { fille }}}
3. Pour prélever 10 mL lors cette dilution, il est préférable d'utiliser
4. Pour préparer une solution de sel de concentration 9 g/L,
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ACourbe d'étalonnage
✔ VAL : appliquer une relation entre des grandeurs physiques
Un laboratoire pharmaceutique souhaite contrôler la concentration en chlorure de sodium d'un sérum physiologique. Pour cela, on réalise par dilution d'une solution mère de concentration connue une série de 4 solutions filles de différentes concentrations. Ensuite, on mesure la conductivité électrique (la capacité à conduire l'électricité) de ces solutions, notée \sigma et exprimée en mS·cm−1. Les résultats sont montrés sur le graphique ci-après. Enfin, on mesure la conductivité du sérum physiologique à contrôler.

1. Rappeler les relations entre \gamma _{\text{mère}}, \gamma _{\text{fille}}, V_{\text{mère}}, V_{\text{fille}} et \text{F} lors d'une dilution.
2. Compléter le tableau suivant qui présente les caractéristiques des 4 dilutions.
3. À l'aide du graphique, justifier que la conductivité \sigma et la concentration \gamma sont proportionnelles.
4. La conductivité du sérum physiologique mesurée est \sigma_{\text{sérum}} = 18{,}5 mS·cm−1. À l'aide du graphique, déterminer la concentration γsérum en chlorure de sodium du sérum physiologique.
2. Compléter le tableau suivant qui présente les caractéristiques des 4 dilutions.
| n° Solution fille | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| \gamma_{\text{mère}} (g·L−1) | 11,6 | 11,6 | 11,6 | 11,6 |
| \gamma_{\text{fille}} (g·L−1) | 6,96 | 2,32 | ||
| V_{\text{mère}} (mL) | 16,0 | 8,0 | 4,0 | |
| V_{\text{fille}} (mL) | 20,0 | 20,0 | ||
| Facteur de dilution \text{F} | 2,5 |
3. À l'aide du graphique, justifier que la conductivité \sigma et la concentration \gamma sont proportionnelles.
4. La conductivité du sérum physiologique mesurée est \sigma_{\text{sérum}} = 18{,}5 mS·cm−1. À l'aide du graphique, déterminer la concentration γsérum en chlorure de sodium du sérum physiologique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BSolution glucosé
✔ ANA : justifier un protocole
Un laboratoire pharmaceutique souhaite préparer une poche de 200 mL d'une solution glucosée pour perfusion à partir de glucose en poudre. Il s'agit d'une solution aqueuse de glucose de concentration massique \gamma = 50{,}0 g·L−1.
Un laboratoire pharmaceutique souhaite préparer une poche de 200 mL d'une solution glucosée pour perfusion à partir de glucose en poudre. Il s'agit d'une solution aqueuse de glucose de concentration massique \gamma = 50{,}0 g·L−1.
1. S'agit-il ici d'une dilution ou d'une dissolution ?
2. Quelle masse de glucose faut-il prélever pour réaliser cette solution ?
3. Remettre les étapes suivantes pour réaliser cette solution dans l'ordre.
a. Rincer l'entonnoir avec de l'eau distillée et verser l'eau de rinçage dans la fiole.
b. Verser le soluté dans une fiole jaugée de volume adéquat à l'aide d'un entonnoir.
2. Quelle masse de glucose faut-il prélever pour réaliser cette solution ?
3. Remettre les étapes suivantes pour réaliser cette solution dans l'ordre.
a. Rincer l'entonnoir avec de l'eau distillée et verser l'eau de rinçage dans la fiole.
b. Verser le soluté dans une fiole jaugée de volume adéquat à l'aide d'un entonnoir.
c. Boucher la fiole et homogénéiser de nouveau.
d. Ajouter du solvant jusqu'au trait de jauge.
e. À l'aide d'une spatule et d'une coupelle, peser une masse adéquate de soluté.
f. Remplir la fiole environ aux 2/3 avec de l'eau distillée, boucher et homogénéiser.
d. Ajouter du solvant jusqu'au trait de jauge.
e. À l'aide d'une spatule et d'une coupelle, peser une masse adéquate de soluté.
f. Remplir la fiole environ aux 2/3 avec de l'eau distillée, boucher et homogénéiser.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille

