Physique-Chimie Cycle 4
Nouveau manuel de Sciences et Technologie 6e
Découvrez cet ouvrage collaboratif, conforme au nouveau programme !
Mes Pages
Thème 1 - Organisation et transformations de la matière
Ch. 1
L'eau que nous buvons est-elle pure ?
Ch. 2
La matière : états, masse et volume
Ch. 3
Les changements d'état de la matière
Ch. 4
Les mélanges
Ch. 5
La matière à l'échelle microscopique
Ch. 6
Que trouve-t-on dans l'air ?
Ch. 7
Les transformations chimiques et la pollution
Ch. 8
Modélisation des transformations chimiques
Ch. 9
Les ions dans notre quotidien
Ch. 10
Quand les acides et les bases réagissent
Ch. 11
Introduction à la masse volumique
Ch. 12
La masse volumique
Ch. 13
La matière, dans l'espace et dans l'Univers
Ch. 14
De l'Univers aux atomes
Thème 2 - Mouvement et interactions
Ch. 15
Introduction à la vitesse et au mouvement
Ch. 16
Repérage de mouvement et mesure de vitesse
Ch. 17
Vitesse et mouvement
Ch. 18
Les interactions
Ch. 19
Les forces
Ch. 20
Le poids
Thème 3 - L'énergie et ses conversions
Ch. 21
Introduire la notion d'énergie
Ch. 22
Conversion et transfert de l'énergie
Ch. 23
La conservation de l'énergie
Ch. 24
Les circuits électriques
Ch. 25
La tension et l'intensité
Ch. 26
Relations entre grandeurs dans les circuits électriques
Ch. 27
Résistance et loi d'Ohm
Ch. 28
Puissance et énergie en électricité
Thème 4 - Des signaux pour observer et communiquer
Ch. 29
Le son
Ch. 30
La lumière
Ch. 31
Vitesse de propagation des signaux
Ch. 32
Des signaux au-delà de la perception humaine
Chapitre 5
Exercices
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je me teste
Je sais
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Les particules sont :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2 Lors d'une dissolution, à l'échelle microscopique :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3La matière est constituée de :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4Une particule :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Si on refroidit une substance, au niveau microscopique, les particules :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6La masse d'un mélange est :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Le modèle particulaire de la matière :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je sais faire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Le mouvement brownien a permis de mieux comprendre le mouvement des particules :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Les particules :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Les trois états de la matière.
Légende le schéma avec les mots suivants : particule - vide - état solide - état liquide - état gazeux.

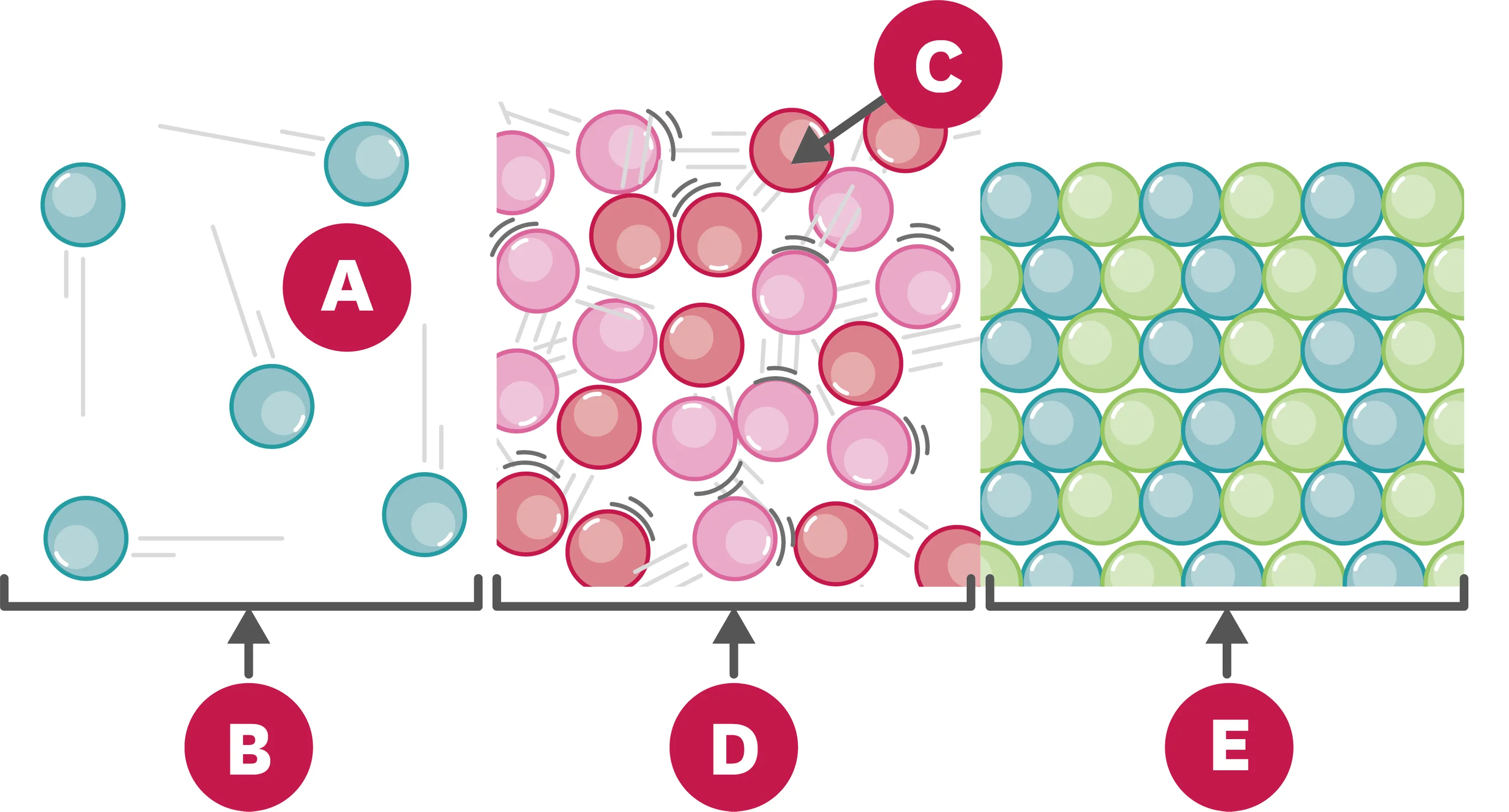


| A | |
| B | |
| C | |
| D | |
| E |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice corrigé
Compétence : Modéliser des phénomènes pour les expliquer.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Un sirop de sucre.
Pour réaliser une recette, Jonathan doit dissoudre du sucre dans l'eau. Il s'interroge sur ce qui se passe pour les particules de ces corps quand ils sont mélangés.
1. Schématise les particules d'eau à l'état liquide en les représentant chacune par un haricot bleu.
2. Schématise les particules du sucre à l'état solide et cristallin en les représentant chacune par un vers rouge.
1. Schématise les particules d'eau à l'état liquide en les représentant chacune par un haricot bleu.
2. Schématise les particules du sucre à l'état solide et cristallin en les représentant chacune par un vers rouge.
3. Les particules changent-elles au cours de la dissolution ?
4. Schématise les particules de la solution d'eau sucrée.
4. Schématise les particules de la solution d'eau sucrée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Étapes de la méthode
- Pour représenter la matière à l'échelle des particules qui la composent, il faut prendre en compte les aspects suivants de leur organisation :
- la distance : les particules sont-elles groupées ou dispersées ?
- la contrainte de mouvement : les particules sont-elles attachées ou libres ?
- Les transformations que l'on observe avec nos yeux peuvent résulter soit du changement d'organisation des particules, soit de la transformation de ces particules. Pour déterminer de quelle situation il s'agit, faut se demander si de nouvelles espèces chimiques font leur apparition ou non.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Corrigé
1. Schéma des particules de l'eau pure à l'état liquide :


2. Schéma des particules du sucre cristallisé :


3. Aucune nouvelle espèce chimique n'étant à priori décelable après cette opération, on peut faire l'hypothèse qu'il s'agit d'une simple réorganisation des particules. Les particules n'ont donc normalement pas changé au cours de la dissolution.
4. Schéma de la solution d'eau sucrée :




2. Schéma des particules du sucre cristallisé :


3. Aucune nouvelle espèce chimique n'étant à priori décelable après cette opération, on peut faire l'hypothèse qu'il s'agit d'une simple réorganisation des particules. Les particules n'ont donc normalement pas changé au cours de la dissolution.
4. Schéma de la solution d'eau sucrée :


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercice similaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12Des molécules rafraichissantes.
Emmanuel veut se servir un verre de menthe à l'eau.1. Représente la situation obtenue au niveau des particules lors du mélange. En considérant que l'eau et le sirop sont des corps purs, on représentera chaque particule de sirop par un △ et chaque particule d'eau par un ◯.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je m'entraine
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Particules et jeux vidéos.
Leïla doit faire un exposé de Physique-Chimie sur l'organisation microscopique de la matière à l'état solide. Elle a l'idée d'utiliser une image de jeu vidéo pour illustrer son travail.


1. Quel est l'état physique initial de l'eau ? Quel est son état final ?
2. Que représente chacun des cubes sur l'image ?
3. Le solide représenté est-il un mélange ou un corps pur ?
4. Quel changement d'état a eu lieu ?
5. Pourquoi un solide a-t-il une forme propre ?
6. Comment évolue la masse de l'eau au cours de ce changement d'état ?


1. Quel est l'état physique initial de l'eau ? Quel est son état final ?
2. Que représente chacun des cubes sur l'image ?
3. Le solide représenté est-il un mélange ou un corps pur ?
4. Quel changement d'état a eu lieu ?
5. Pourquoi un solide a-t-il une forme propre ?
6. Comment évolue la masse de l'eau au cours de ce changement d'état ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Mélanges homogènes et hétérogènes au niveau microscopique.
On représente au niveau microscopique des mélanges de deux liquides.

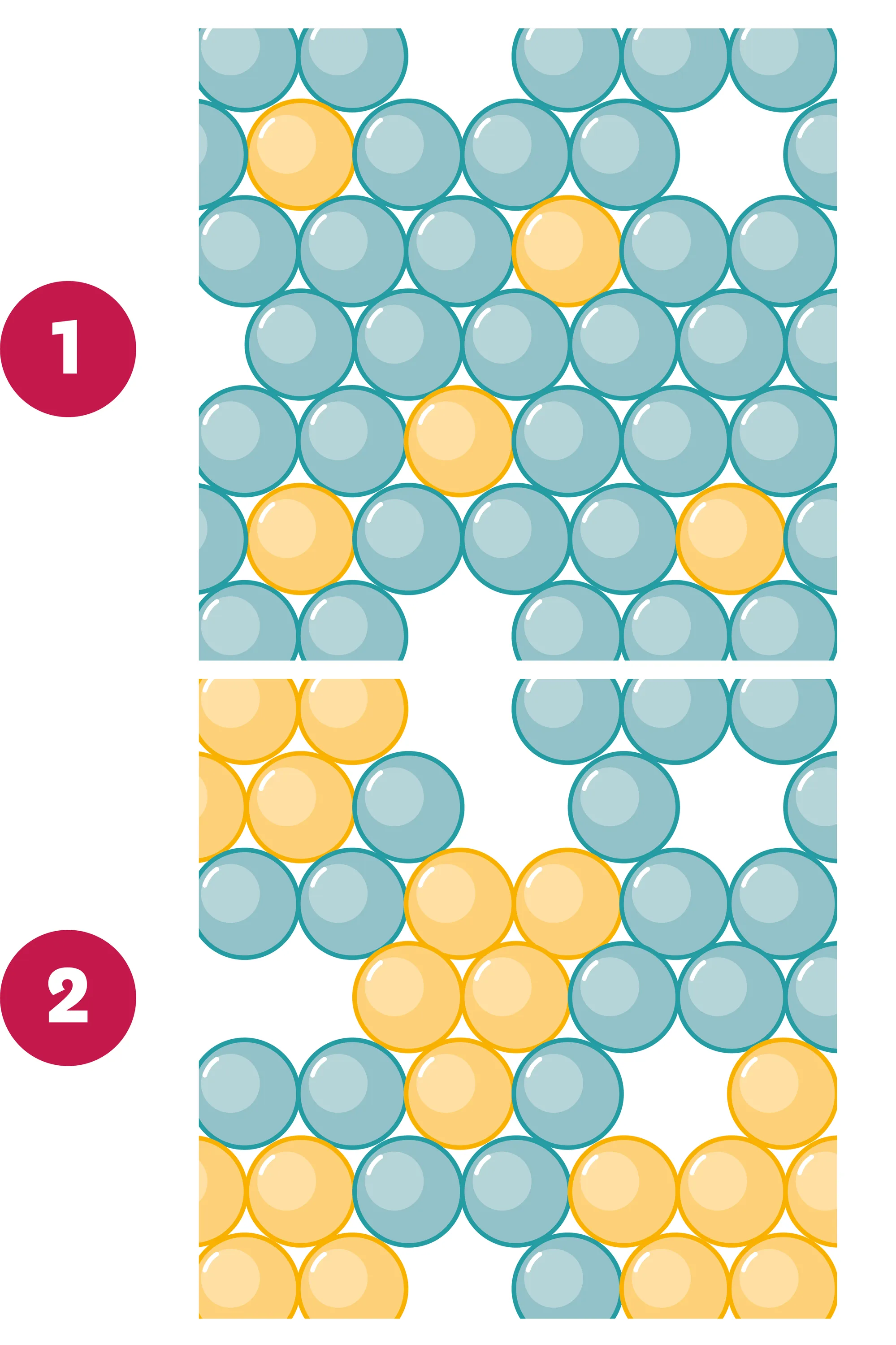
1. Quelle représentation correspond à un mélange homogène ? Explique ton raisonnement.
2. Quelle représentation correspond à un mélange hétérogène ? Explique ton raisonnement.


1. Quelle représentation correspond à un mélange homogène ? Explique ton raisonnement.
2. Quelle représentation correspond à un mélange hétérogène ? Explique ton raisonnement.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Dissolution et aspect microscopique.
Enzo dissout complètement 30 g de fructose (un corps pur) dans 200 mL d'eau pure.
1. Combien d'espèces chimiques sont présentes dans ce mélange ?
2. Est-ce un mélange homogène ou hétérogène ?
3. Dessine une représentation à l'échelle microscopique de ce mélange et légende ton schéma.
1. Combien d'espèces chimiques sont présentes dans ce mélange ?
2. Est-ce un mélange homogène ou hétérogène ?
3. Dessine une représentation à l'échelle microscopique de ce mélange et légende ton schéma.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Liquides non miscibles et aspect microscopique.
Compétence
Modéliser des phénomènes pour les expliquer.
On mélange de l'eau et de l'huile : on obtient un mélange hétérogène.
1. Combien de sortes de molécules sont présentes dans le mélange ?
2. Dessine une représentation de ce mélange à l'échelle microscopique et légende ton schéma.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Ébullition à l'échelle des particules.
Compétence
Écrire des phrases claires, sans faute, en utilisant le vocabulaire adapté.
On fait chauffer de l'eau liquide jusqu'à la porter à ébullition.
1. Décris à l'échelle des particules ce qui se passe au début du chauffage et lors de l'ébullition.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18À l'échelle microscopique.
Compétence
Comprendre et interpréter des tableaux ou des documents graphiques.
Voici une représentation de l'eau à l'échelle microscopique :


1. Indique s'il s'agit d'eau à l'état liquide, solide ou gazeux. Justifie ta réponse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19Les molécules présentes dans une cellule.
Les êtres vivants sont constitués de cellules. En moyenne, une cellule contient 200 000 milliards de particules (deux suivi de quatorze zéros). On trouve :
- 98,73 % de molécules d'eau ;
- 0,47 % de molécules de divers lipides ;
- 0,01 % de molécules de diverses protéines.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20Masse et fusion de l'eau.
Léa réalise l'expérience suivante :

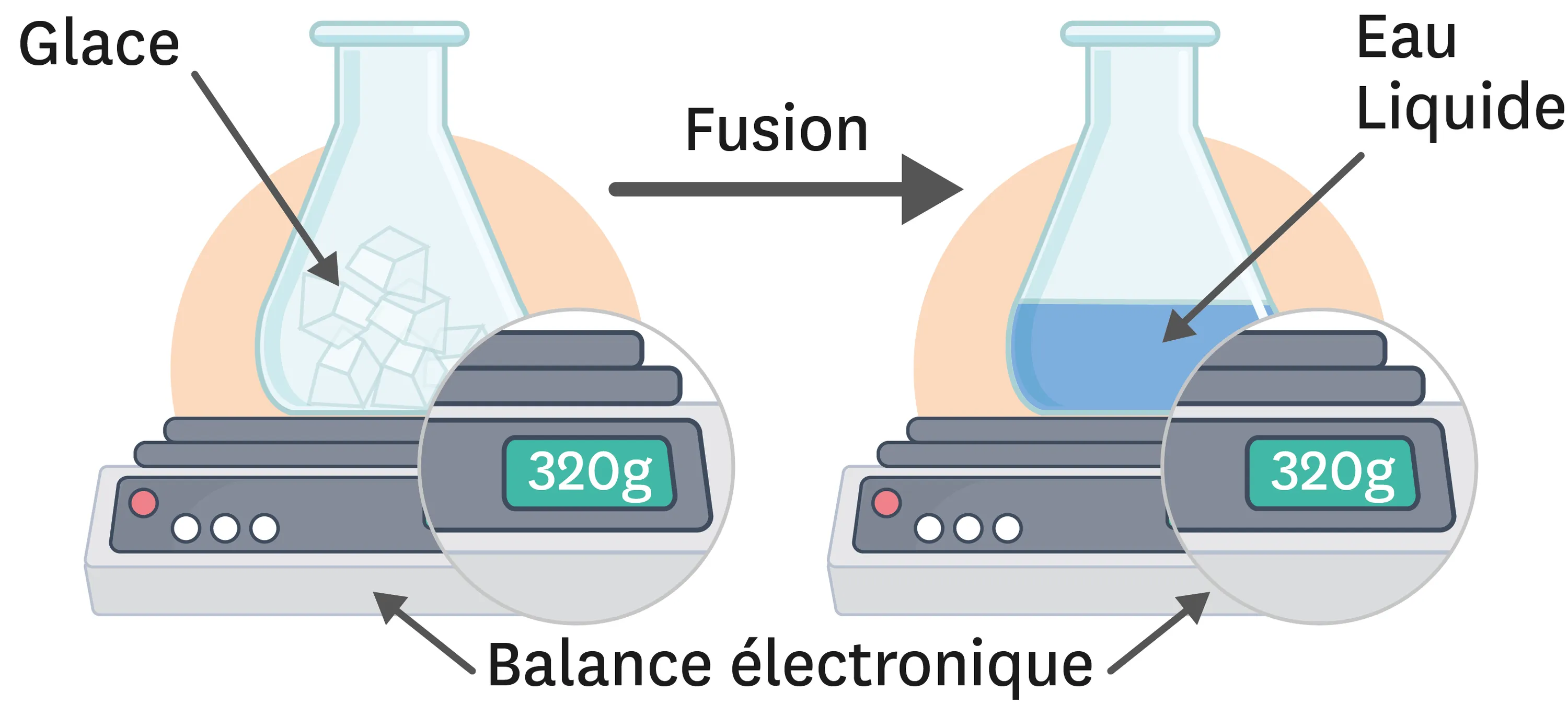
1. Quel est l'état physique initial de l'eau ? Quel est son état final ?
2. Quel changement d'état a eu lieu ?


1. Quel est l'état physique initial de l'eau ? Quel est son état final ?
2. Quel changement d'état a eu lieu ?
3. Comment évolue la masse de l'eau au cours de ce changement d'état ?
4. Propose une interprétation microscopique de cette observation expérimentale.
4. Propose une interprétation microscopique de cette observation expérimentale.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices Différenciation
Compétence : Modéliser des phénomènes pour les expliquer.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21-AModèle particulaire et filtration. Un masque contre la pollution.
Chaque hiver, les grandes agglomérations en France rencontrent des situations d'alerte à la pollution atmosphérique. Il est recommandé aux personnes à risques et aux sportifs de porter un masque pour sortir.

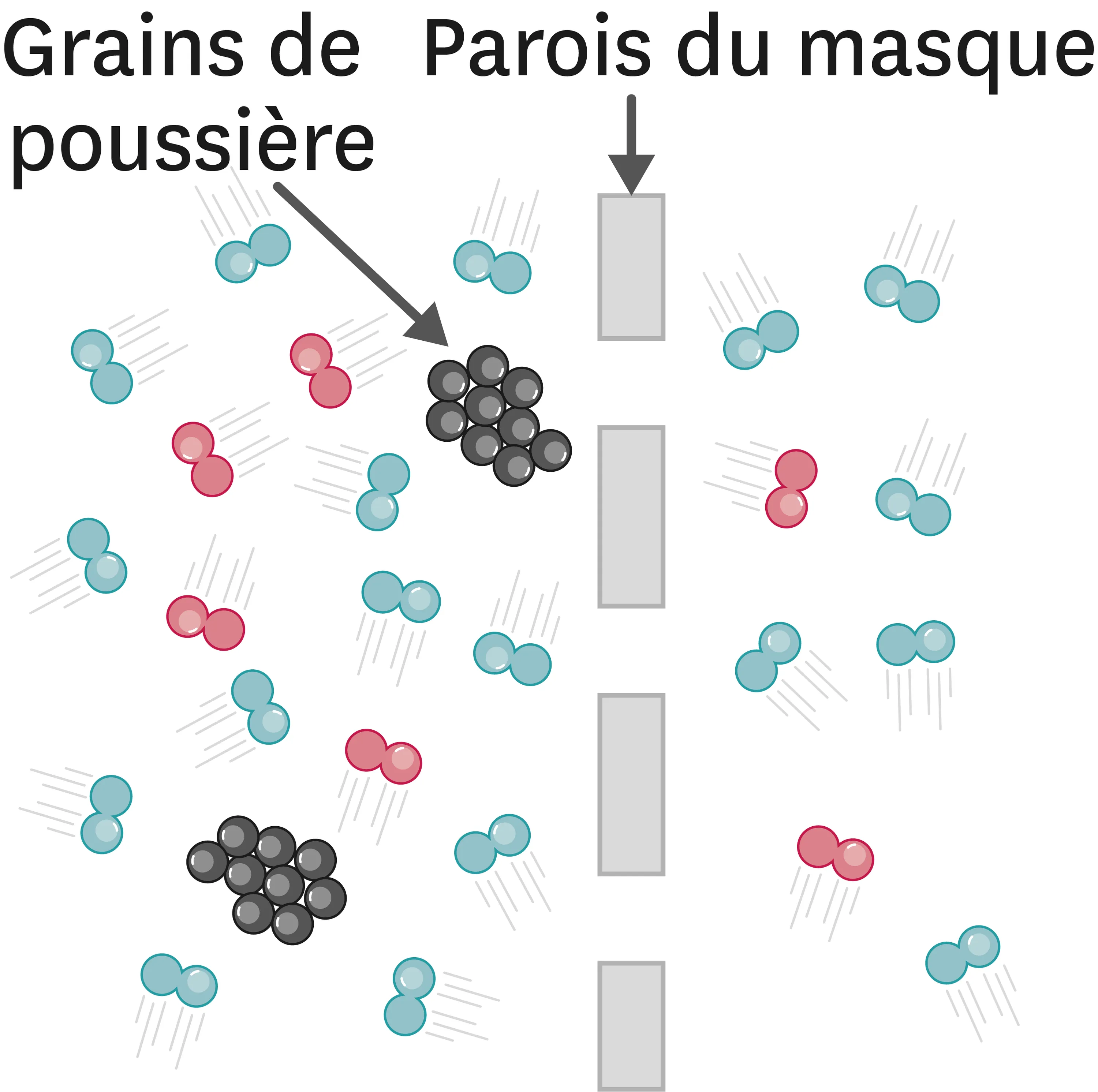
1. Quel est l'état physique des constituants de l'air (en rouge et en bleu) ?
2. Quel est l'état physique des grains de poussière polluante ?


1. Quel est l'état physique des constituants de l'air (en rouge et en bleu) ?
2. Quel est l'état physique des grains de poussière polluante ?
3. Compare la taille des constituants de l'air et des trous du masque.
4. Compare la taille des grains de poussière et des trous du masque.
5. Comment un filtre sépare-t-il les constituants de l'air des grains de poussière ?
4. Compare la taille des grains de poussière et des trous du masque.
5. Comment un filtre sépare-t-il les constituants de l'air des grains de poussière ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21-BModèle particulaire et filtration. De l'eau sucrée.
Manon dissout du sucre dans de l'eau mais elle en met trop : il reste du sucre solide non dissout. Elle souhaite le récupérer.
1. Décris, au niveau macroscopique, comment un filtre sépare l'eau et le sucre non dissout.
2. Fais un schéma représentant un filtre et faisant apparaitre les trous qu'il comporte.
3. Complète le schéma en représentant les particules qui constituent un grain de sucre et celles qui constituent l'eau sucrée.
1. Décris, au niveau macroscopique, comment un filtre sépare l'eau et le sucre non dissout.
2. Fais un schéma représentant un filtre et faisant apparaitre les trous qu'il comporte.
3. Complète le schéma en représentant les particules qui constituent un grain de sucre et celles qui constituent l'eau sucrée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21-CModèle particulaire et filtration. Filtration d'une eau sableuse.
Noé réalise une filtration pour séparer de l'eau du sable qu'elle contient.




1. Explique, au niveau microscopique, comment le sable va être filtré. Fais un schéma et rédige une explication.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
J'approfondis
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22Diffusion des gaz.
Compétence
Modéliser des phénomènes pour les expliquer.
Le dioxyde d'azote est un gaz de couleur rousse. On réalise l'expérience suivante. Attention, ce gaz est toxique et son usage réclame des précautions particulières d'utilisation.

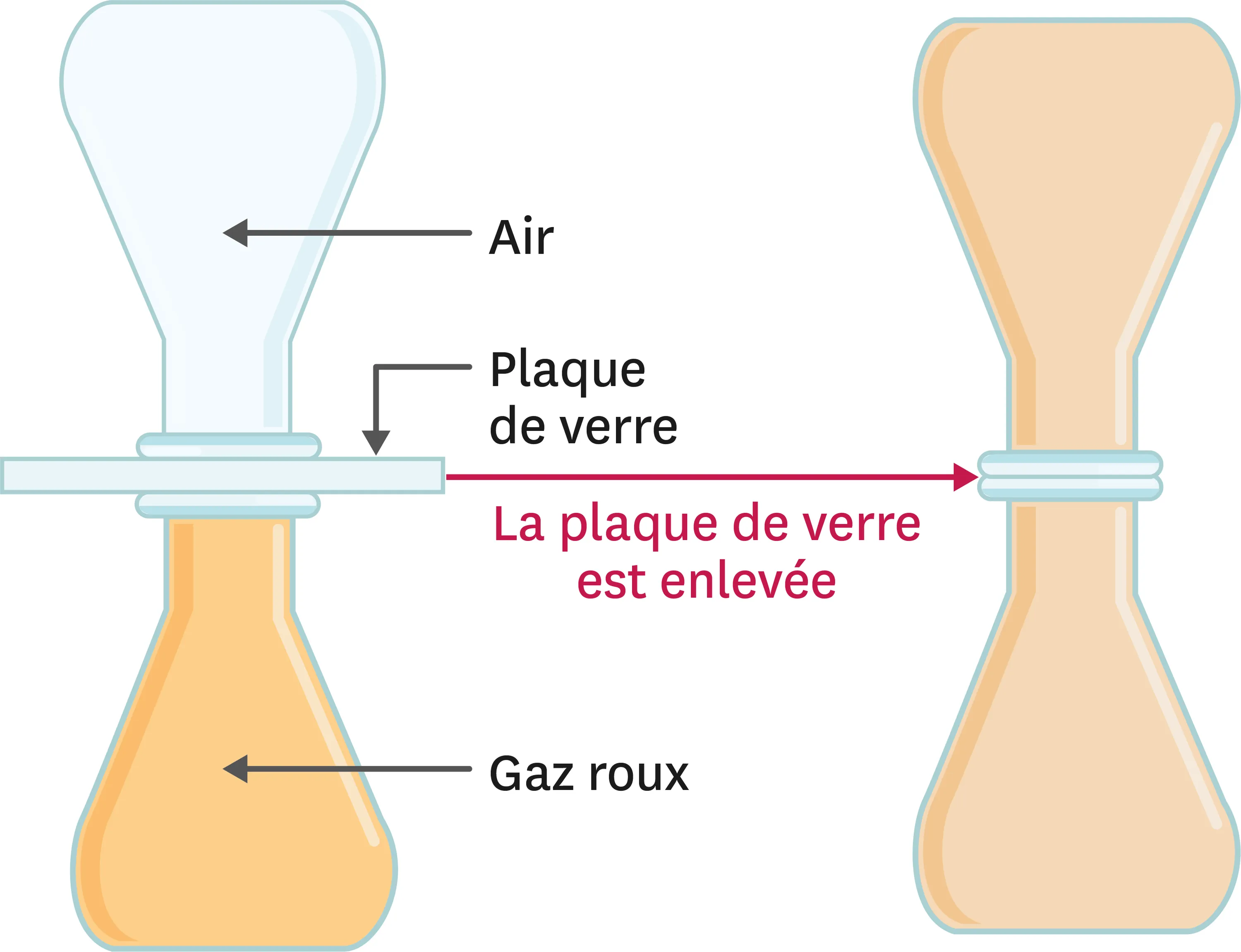
1. Qu'observes-tu lors de cette expérience ?


1. Qu'observes-tu lors de cette expérience ?
2. Schématise les molécules présentes dans chacun des récipients au début et à la fin de l'expérience (tu considéreras que l'air est constitué d'un seul type de particules tout comme le dioxyde d'azote.
3. Explique pourquoi un gaz n'a ni forme ni volume propre.
3. Explique pourquoi un gaz n'a ni forme ni volume propre.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23Tout est une histoire de particules.
On dépose un glaçon dans un bécher. On place le bécher sur une plaque chauffante que l'on allume. On éteint la plaque chauffante lorsqu'il ne reste presque plus d'eau dans le bécher.
1. Qu'est-il arrivé à l'eau qui constituait le glaçon ?
2. Dessine l'allure de la courbe représentant la température de l'eau en fonction de la durée du chauffage.
3. Pour chaque partie de la courbe, décris le changement qui s'opère pour les particules d'eau.
1. Qu'est-il arrivé à l'eau qui constituait le glaçon ?
2. Dessine l'allure de la courbe représentant la température de l'eau en fonction de la durée du chauffage.
3. Pour chaque partie de la courbe, décris le changement qui s'opère pour les particules d'eau.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24Ébullition et évaporation.
On verse de l'eau dans une casserole que l'on dépose sur le rebord de la fenêtre. Au bout d'une journée, le niveau de l'eau aura baissé et cela s'accentuera les jours suivants. En effet, l'eau va s'évaporer progressivement, passant à l'état gazeux au niveau de la surface de contact entre l'eau et l'air ambiant. Plus la surface de la casserole est grande, plus l'évaporation sera rapide.
Si on souhaite obtenir le même résultat plus rapidement encore, il suffit de faire chauffer la casserole. Au bout d'un moment, des bulles de gaz vont se former de façon régulière au sein du liquide et son niveau va baisser rapidement. Il s'agit d'une ébullition car des bulles de vapeur d'eau se forment dans l'ensemble du volume du liquide.
1. Quel est le nom utilisé pour désigner le changement d'état dont il est question ici ?
2. À l'aide du texte ci-dessus, explique pourquoi on dit que l'évaporation est un phénomène surfacique et l'ébullition un phénomène volumique.
3. Quelle conséquence cela a-t-il pour les vitesses de ces deux phénomènes ?
4. Cite en t'aidant du texte ci-dessus, trois paramètres qui influencent la vitesse de l'évaporation.
5. Fais un schéma qui représente le phénomène d'évaporation au niveau microscopique.
Si on souhaite obtenir le même résultat plus rapidement encore, il suffit de faire chauffer la casserole. Au bout d'un moment, des bulles de gaz vont se former de façon régulière au sein du liquide et son niveau va baisser rapidement. Il s'agit d'une ébullition car des bulles de vapeur d'eau se forment dans l'ensemble du volume du liquide.
1. Quel est le nom utilisé pour désigner le changement d'état dont il est question ici ?
2. À l'aide du texte ci-dessus, explique pourquoi on dit que l'évaporation est un phénomène surfacique et l'ébullition un phénomène volumique.
3. Quelle conséquence cela a-t-il pour les vitesses de ces deux phénomènes ?
4. Cite en t'aidant du texte ci-dessus, trois paramètres qui influencent la vitesse de l'évaporation.
5. Fais un schéma qui représente le phénomène d'évaporation au niveau microscopique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
25La danse des particules.
On peut se représenter le mouvement des molécules en effectuant une chorégraphie dans la classe, chaque élève se comportant comme une molécule. Créez une chorégraphie qui met en scène :
1. la fusion d'un solide ;
2. la dissolution d'un solide dans un liquide ;
3. le mélange de deux liquides non miscibles.
1. la fusion d'un solide ;
2. la dissolution d'un solide dans un liquide ;
3. le mélange de deux liquides non miscibles.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
26Un parfum dans l'air.
En ouvrant un flacon de parfum, il flotte vite dans l'air une odeur agréable.
1. Schématise un flacon de parfum incliné et représente la surface libre du parfum.
2. Représente les particules de parfum au niveau microscopique (bien que ce ne soit pas un corps pur, tu pourras représenter des particules toutes identiques).
3. Représente sur le schéma le phénomène impliqué par la diffusion de l'odeur.


1. Schématise un flacon de parfum incliné et représente la surface libre du parfum.
2. Représente les particules de parfum au niveau microscopique (bien que ce ne soit pas un corps pur, tu pourras représenter des particules toutes identiques).
3. Représente sur le schéma le phénomène impliqué par la diffusion de l'odeur.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
27Conservation de la masse.
Caroline a appris en classe qu'au cours d'une dissolution, la masse de la solution est égale à la somme des masses du solvant et du soluté.
Elle aimerait modéliser cette propriété à l'aide d'un modèle particulaire dans le cas de la dissolution de sel dans l'eau.
1. Représente le sel à l'échelle microscopique. Tu pourras choisir n'importe quelle forme de particule.
2. Représente l'eau à l'échelle microscopique.
3. Représente le mélange du sel et de l'eau.
4. À quel détail dois-tu faire attention pour bien montrer que la masse se conserve ?
Elle aimerait modéliser cette propriété à l'aide d'un modèle particulaire dans le cas de la dissolution de sel dans l'eau.
1. Représente le sel à l'échelle microscopique. Tu pourras choisir n'importe quelle forme de particule.
2. Représente l'eau à l'échelle microscopique.
3. Représente le mélange du sel et de l'eau.
4. À quel détail dois-tu faire attention pour bien montrer que la masse se conserve ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
28Une nouvelle échelle de températures.
Au quotidien, on mesure les températures en degrés Celsius. 0 °C correspond à la température de fusion de l'eau solide dans des conditions standards. En 1848, Lord Kelvin a montré qu'il existe une température en-dessous de laquelle il est impossible de descendre : le zéro absolu. Cela correspond à -273,15 °C ou 0 K dans l'échelle de Kelvin.
1. Quelle est la température la plus faible dans l'univers (en degrés Celsius) ?
2. Quelle est la température de fusion de l'eau solide en Kelvin ?
3. Quelle est la température de vaporisation de l'eau liquide en degrés Celsius et en Kelvin ?
4. Au niveau microscopique, comment évolue le mouvement des particules d'eau si la température diminue ?
5. Propose une hypothèse sur le mouvement des particules d'eau à la température du zéro absolu.
1. Quelle est la température la plus faible dans l'univers (en degrés Celsius) ?
2. Quelle est la température de fusion de l'eau solide en Kelvin ?
3. Quelle est la température de vaporisation de l'eau liquide en degrés Celsius et en Kelvin ?
4. Au niveau microscopique, comment évolue le mouvement des particules d'eau si la température diminue ?
5. Propose une hypothèse sur le mouvement des particules d'eau à la température du zéro absolu.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29La membrane Gore-Tex.
Compétence
Interpréter des résultats.
La membrane Gore-Tex est un tissu imperméable et respirant. C'est une couche fine qui contient des milliards de trous microscopiques d'un diamètre d'environ 0,2 micromètre appelés « pores ». Chaque pore est 20 000 fois plus petit qu'une goutte d'eau et 700 fois plus grand qu'une molécule d'eau.
1. Pourquoi la pluie ne peut-elle pas traverser la membrane ?
2. Pourquoi la vapeur d'eau due à la transpiration peut-elle traverser la membrane ?
1. Pourquoi la pluie ne peut-elle pas traverser la membrane ?
2. Pourquoi la vapeur d'eau due à la transpiration peut-elle traverser la membrane ?
3. Calcule la taille approximative d'une molécule d'eau.
4. Pourquoi peut-on dire que ce tissu est imperméable et respirant ?
4. Pourquoi peut-on dire que ce tissu est imperméable et respirant ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Je résous un problème
Compétence : Mettre en œuvre un raisonnement logique simple pour résoudre un problème.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
À l'ouverture d'une boite de chocolats, avant même de déguster le contenu, on peut en apprécier l'aspect brillant et le décor travaillé. Pourtant, lorsque l'on essaie d'en confectionner soi-même, le chocolat est mat et terne avec parfois des traces blanches à sa surface.
Explique à l'échelle des particules comment les différentes étapes de la préparation du chocolatier permettent d'obtenir du chocolat brillant et croquant.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Beurre de cacao : un seul liquide pour plusieurs solides possibles.
Le chocolat contient au minimum 31 % minimum de beurre de cacao. À l'état solide, 5 cristallisations différentes sont possibles pour les molécules de ce beurre. Les formes 1 à 3 évoluent spontanément vers les formes 4 et 5, plus stables, en provoquant l'apparition de taches blanches peu appétissantes. La technique du tempérage, permet d'obtenir d'emblée, par pré-cristallisation, uniquement les cristaux de la forme 4 qui rend le chocolat croquant et brillant.
| Cristaux | 1 | 2 | 3 | 4 | 5 |
| Températures de solidification (plage en °C) | 16 à 18 | 21 à 24 | 27 à 29 | 31 à 34 | 34 à 37 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Courbe de température à suivre pour sélectionner les cristaux de forme 4.

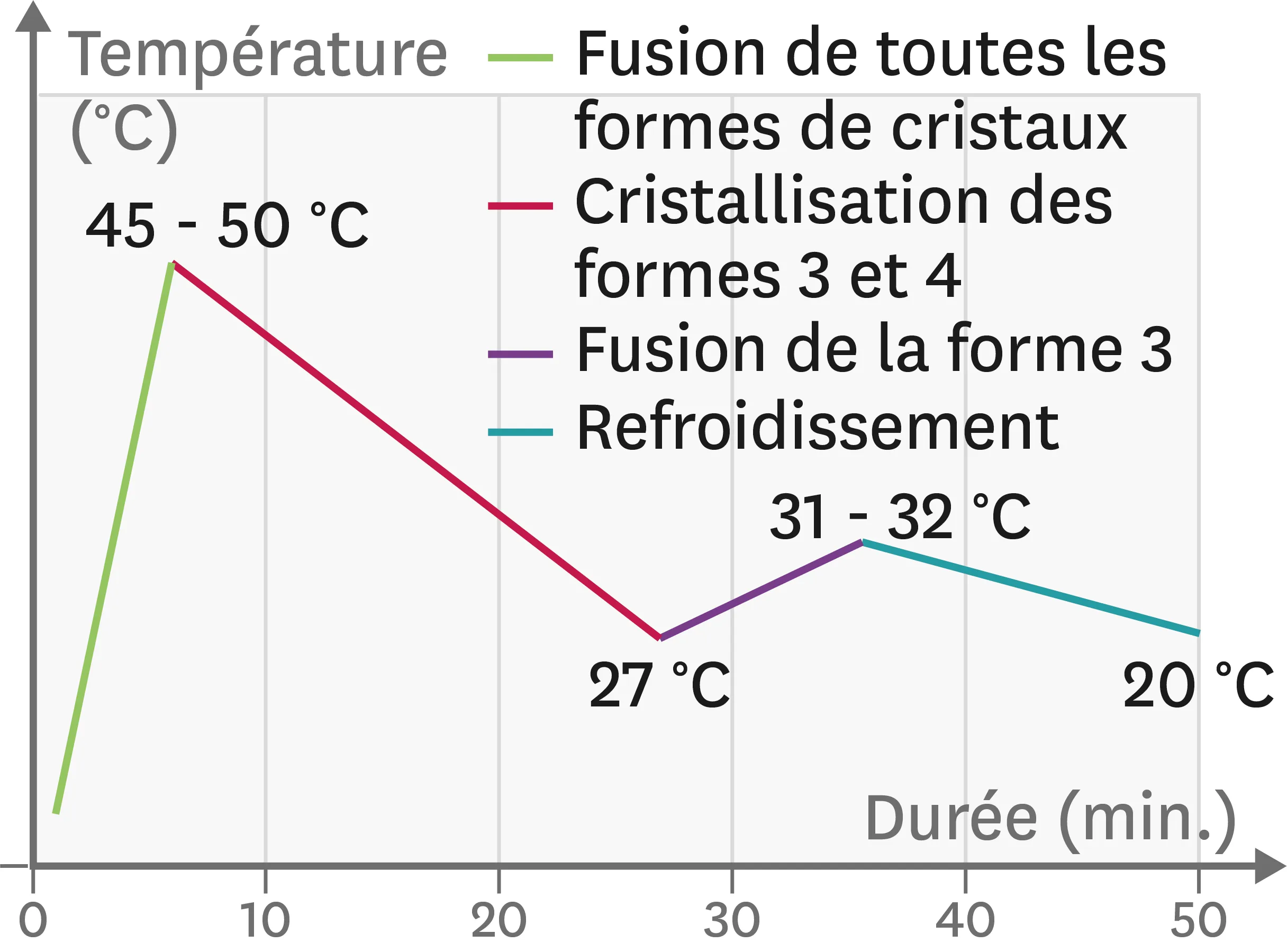
Lors de la solidification finale du beurre de cacao, la cristallisation qui s'opère est « guidée » par les cristaux présents à ce moment-là dans la préparation.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Exercices supplémentaires
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Modèle moléculaire d'un gaz.
1. Les mots ou groupes de mots suivants caractérisent les molécules dans l'état gazeux excepté un. Quel est l'intrus ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Les molécules présentent dans une cellule
Les êtres vivants sont constitués de cellules. En moyenne, une cellule contient 200 000 milliards de particules (2 suivi de quatorze zéros). On trouve :
- 98,73 % de molécules d'eau
- 0,47 % de molécules de divers lipides
- 0,01 % de molécules de diverses protéines
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32Le quatrième état de la matière : le plasma.
99 % de l'univers visible n'est pas l'état solide, ni liquide, ni gazeux mais à l'état de plasma. Le Soleil, la foudre et les aurores boréales sont des exemples de plasmas naturels. Les néons et certains écrans sont des plasmas fabriqués par l'Homme.
Pour créer un plasma, on apporte de l'énergie à un gaz. Un mélange complexe de particules plus petites que celles étudiées dans ce chapitre se crée. On trouve des atomes ou des molécules qui, du fait de la grande énergie présente, sont « épluchés » de leurs électrons, formant une sorte de gaz constitués d'ions et d'électrons.
1. Quel est le quatrième état fondamental de la matière ?
2. Est-ce que les particules dans un plasma ont une faible ou une haute énergie ?
3. Quelles sont les particules qui sont citées dans le texte ?


Pour créer un plasma, on apporte de l'énergie à un gaz. Un mélange complexe de particules plus petites que celles étudiées dans ce chapitre se crée. On trouve des atomes ou des molécules qui, du fait de la grande énergie présente, sont « épluchés » de leurs électrons, formant une sorte de gaz constitués d'ions et d'électrons.
1. Quel est le quatrième état fondamental de la matière ?
2. Est-ce que les particules dans un plasma ont une faible ou une haute énergie ?
3. Quelles sont les particules qui sont citées dans le texte ?


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Le quatrième état de la matière : le plasma.
Le sucre utilisé en confiserie est le plus souvent constitué de particules de saccharose. Quand un sirop de sucre refroidit, ces particules vont se liées entre elles pour constituer du sucre solide. Pour fabriquer une confiserie crémeuse, on favorise la constitution de cristaux entre ces particules par un chauffage doux.
Au contraire, pour fabriquer une sucrerie dure et cassante, on empêche la formation de cristaux par un chauffage plus brutal et l'ajoute d'autres sucres comme le glucose de taille différente.
1. Quel est le nom de la particule qui compose le plus souvent les sucres ?
2. Un caramel est-il constitué de solides cristallin ou amorphe ?
3. Même question pour une sucette ?
Au contraire, pour fabriquer une sucrerie dure et cassante, on empêche la formation de cristaux par un chauffage plus brutal et l'ajoute d'autres sucres comme le glucose de taille différente.
1. Quel est le nom de la particule qui compose le plus souvent les sucres ?
2. Un caramel est-il constitué de solides cristallin ou amorphe ?
3. Même question pour une sucette ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34Une année miraculeuse.
En 1905, Albert Einstein publia quatre articles scientifiques qui bouleversèrent les sciences physiques dans de nombreux domaines. Il avait alors 26 ans. C'est ce qu'on appelle son année miraculeuse. Un de ces articles proposait une explication du mouvement brownien.
1. Au niveau microscopique, de quoi est constituée l'eau liquide (en considérant que c'est un corps pur) ?
2. Décris le mouvement des constituants de l'eau.
3. Pourquoi est-ce que les grains de pollens dans l'eau ont un mouvement rapide et désordonné ?
1. Au niveau microscopique, de quoi est constituée l'eau liquide (en considérant que c'est un corps pur) ?
2. Décris le mouvement des constituants de l'eau.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Parcours de compétences
Compétence : Modéliser des phénomènes pour les expliquer.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
35Une année miraculeuse.
Relis le texte concernant la membrane Gore-Tex (exercice n° 29).
1. Fais un schéma représentant la membrane en Gore-Tex et la manière dont les gouttes d'eau sont bloquées tandis que les particules d'eau passent.
1. Fais un schéma représentant la membrane en Gore-Tex et la manière dont les gouttes d'eau sont bloquées tandis que les particules d'eau passent.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 1
J'identifie le phénomène physique à expliquer.
Coup de pouce
Dans quel état physique se trouve l'eau lorsqu'elle est sous forme de gouttes ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 2
Je fais le lien entre le phénomène et le modèle qui m'est proposé pour expliquer.
Coup de pouce
Regarde le bilan et décris l'organisation des particules à l'état liquide.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 3
J'utilise le modèle qui m'est proposé pour expliquer le phénomène.
Coup de pouce
Ta représentation doit faire apparaitre la différence entre la goutte d'eau liquide et la particule.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Niveau 4
Je propose un modèle permettant d'expliquer le phénomène.
Coup de pouce
Vérifie que la taille des trous de ta membrane permet d'expliquer ce qu'il se passe.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
