Enseignement scientifique 1re - 2023
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Esprit critique
Une longue histoire de la matière
Ch. 1
Les éléments chimiques
Ch. 2
Les cristaux, des édifices ordonnés
Ch. 3
Une structure complexe : la cellule
Le Soleil, notre source d'énergie
Ch. 4
Le rayonnement solaire
Ch. 5
Le bilan radiatif terrestre
Ch. 6
Énergie solaire, photosynthèse et nutrition
Ch. 7
Énergie solaire et humanité
La Terre, un astre singulier
Ch. 8
La forme de la Terre
Ch. 9
L’Histoire de l'âge de la Terre
Ch. 10
La Terre dans l'Univers
Son et musique, porteurs d'information
Ch. 11
Son et musique
Ch. 12
Le son, une information à coder
Ch. 13
Entendre et protéger son audition
Projet expérimental et numérique
Livret Maths
Annexes
Thème 1
Exercice
Se préparer à l'évaluation
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1La datation de peintures rupestres
Coup de pouceCalculatrice autorisée
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La grotte Chauvet-Pont d'Arc a été découverte en 1994 dans le cadre d'une exploration spéléologique. Il s'agit de l'un des sites de peintures rupestres les plus remarquables. Les œuvres peintes datent de l'Aurignacien et témoignent d'une remarquable maîtrise des techniques picturales.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Une peinture rupestre à la grotte Chauvet-Pont d'Arc


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2La formation du carbone 14

La demi-vie des noyaux de carbone 14 est de 5 730 années. Ces noyaux sont continuellement produits dans la haute atmosphère grâce à des réactions nucléaires entre les noyaux d'azote 14 de l'air et des neutrons d'origine cosmique.
De fait, la proportion de noyaux de carbone 14 ^{14}\text{C} dans l'atmosphère par rapport à l'ensemble des noyaux de carbone reste constante.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3La méthode de datation au carbone 14
Un organisme vivant possède la même proportion en noyau de carbone 14 que l'atmosphère mais lorsque celui-ci meurt, ses échanges de matière avec le milieu extérieur cessent et son taux en noyau de carbone 14 décroît alors selon une loi de décroissance radioactive.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
1. Retracer l'origine du carbone 14 dans l'atmosphère, en présentant l'équation de la réaction nucléaire traduisant son processus de formation.
2. Expliquer la présence de carbone 14 dans les pigments naturels utilisés par les artistes rupestres.
3. Les échantillons de pigments récoltés donnent une proportion mesurée en noyau de carbone 14 de \frac{N_{{14}_{C}}}{N_{c}}=1,3 \times 10^{-14}. Peut-on déterminer graphiquement l'âge de ces peintures rupestres ?
4. La proportion en noyaux de carbone 14 diminue de moitié à chaque demi-vie t_{1 / 2} écoulée. Évaluer l'âge des peintures rupestres. Peut-on confirmer que ces peintures datent de l'Aurignacien, dont la période s'étend de -43 000 à -29 000 ans ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1. Les neutrons sont représentés en gris et les protons en rouge.
2. Les pigments sont d'origine végétale. Il faut détailler le processus qui permet aux noyaux de carbone 14 de passer de l'atmosphère (sous forme de dioxyde de carbone \mathrm{CO}_2) aux pigments.
3. Attention à la puissance de 10.
4. Réaliser des divisions par 2 successives.
2. Les pigments sont d'origine végétale. Il faut détailler le processus qui permet aux noyaux de carbone 14 de passer de l'atmosphère (sous forme de dioxyde de carbone \mathrm{CO}_2) aux pigments.
3. Attention à la puissance de 10.
4. Réaliser des divisions par 2 successives.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2L'abondance des éléments chimiques
Coups de pouceCalculatrice autorisée
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Dans un laboratoire, des échantillons X et Y ont perdu leur étiquette. On cherche à retrouver leur nature : matière issue
du vivant ou de la croûte terrestre ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1
Doc. ALes abondances massiques des éléments chimiques dans le coprs humain

Doc. BLes abondances massiques des éléments chimiques dans la croûte terrestre
| Élément | Pourcentage massique |
|---|---|
| Fer Fe | 6 % |
| Silicium Si | 28 % |
| Calcium Ca | 4 % |
| Oxygène O | 46 % |
| Aluminium Al | 8 % |
| Autres | 8 % |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
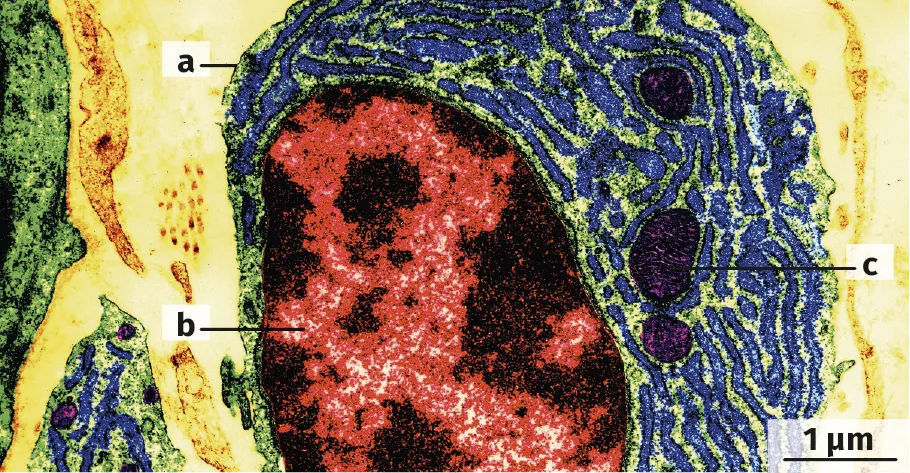
Doc. 2Une microphotographie d'une coupe ultra-fine de l'échantillon Y (couleurs artificielles)

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Une représentation schématique d'un lipide

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
1. Indiquer les deux types de réactions ayant permis de former les éléments chimiques.
2. Comparer les trois éléments les plus abondants dans la croûte terrestre avec ceux de l'être vivant. En déduire une stratégie de résolution du problème.
3. L'échantillon X pèse 41,67 mg et contient, entre autres : 18,05 mg d'oxygène, 9,53 mg de silicium et 2,88 mg de calcium. Calculer les pourcentages massiques pour chaque élément. Formuler une hypothèse sur la nature de l'échantillon.
4. Identifier l'échantillon Y par sa structure. Proposer des noms pour les structures a, b et c sur l'échantillon.
5. L'analyse de l'échantillon Y montre qu'il est riche en molécules organiques comme le lipide du doc. 3 dont la masse est de 126,8 \times 10^{-26} \mathrm{~kg}. Calculer l'abondance massique de l'oxygène et l'abondance massique du carbone dans cette molécule. Comparer le résultat avec les données du doc. 1 et proposer une explication à la différence constatée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Masse moyenne de l'oxygène : m_O=2,66 \times 10^{-26} \mathrm{~kg}
- Masse moyenne du carbone : m_C=1,99 \times 10^{-26} \mathrm{~kg}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1. Se souvenir des réactions nucléaires apprises.
2. Les deux parties du doc. 1 apportent le même type d'information : chercher les 3 pourcentages les plus élevés, puis indiquer s'ils concernent les mêmes éléments chimiques.
3. On connaît la masse de divers éléments chimiques de l'échantillon et sa masse totale. À l'aide d'une relation de proportionnalité, on peut calculer la masse de chaque élément pour une masse totale de 100 mg. On peut ensuite comparer ces valeurs à celles du doc. 1 pour formuler l'hypothèse.
4. Bien observer l'échelle.
5. De quoi est majoritairement composé le corps humain ?
2. Les deux parties du doc. 1 apportent le même type d'information : chercher les 3 pourcentages les plus élevés, puis indiquer s'ils concernent les mêmes éléments chimiques.
3. On connaît la masse de divers éléments chimiques de l'échantillon et sa masse totale. À l'aide d'une relation de proportionnalité, on peut calculer la masse de chaque élément pour une masse totale de 100 mg. On peut ensuite comparer ces valeurs à celles du doc. 1 pour formuler l'hypothèse.
4. Bien observer l'échelle.
5. De quoi est majoritairement composé le corps humain ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3La nucléosynthèse stellaire
RésolutionCalculatrice interdite
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La diversité de la matière provient à l'origine des réactions nucléaires qui se produisent dans les étoiles. Ces réactions engendrent la formation de noyaux plus lourds que celui de l'hydrogène.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1La nucléosynthèse stellaire

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Quelques secondes après l'explosion originelle, les seuls noyaux présents étaient ceux de l'hydrogène, de l'hélium et du lithium.
1. La synthèse des noyaux plus lourds est réalisée grâce aux réactions nucléaires. Expliquer pourquoi cette synthèse ne peut pas se produire à partir de réactions chimiques.
2. Lorsque le cœur d'une étoile est à une température de l'ordre de 1,5 \times 10^{7} \mathrm{~K}, les noyaux d'hydrogène subissent des réactions de fusion conduisant à la formation de noyaux d'hélium selon le processus en chaîne suivant :
a. { }_{1}^{1} \mathrm{H}+{ }_{1}^{1} \mathrm{H} \longrightarrow{ }_{1}^{2} \mathrm{H}+{ }_{1}^{0} \mathrm{e}^{+}
b. { }_{1}^{1} \mathrm{H}+{ }_{1}^{2} \mathrm{H} \longrightarrow{ }_{2}^{3} \mathrm{He}+\gamma
c. { }_{2}^{3} \mathrm{He}+{ }_{2}^{3} \mathrm{He} \rightarrow{ }_{2}^{4} \mathrm{He}+{ }_{1}^{0} \mathrm{e}^{+}
À partir d'une combinaison des équations précédentes, retrouver le bilan de la réaction de formation des noyaux d'hélium à partir de noyaux d'hydrogène.
3. Lorsque la température est de l'ordre de 10^{8} \mathrm{~K}, deux noyaux d'hélium se transforment en un noyau de béryllium 8 radioactif, de très courte demi-vie \left(t_{1 / 2}=6,9 \times 10^{-17} \mathrm{~s}\right), suivant la réaction nucléaire d'équation :
4. Si on note N_{0} le nombre de noyaux de béryllium 8 initialement formés, donner le pourcentage restant après 6,9 \times 10^{-17} \mathrm{~s}.
5. Le béryllium 8 s'associe avec un noyau d'hélium déjà présent au cœur de l'étoile pour former du carbone { }_{\;6}^{12} \mathrm{C}. Proposer une équation à cette réaction.
6. La dernière étape, la nucléosynthèse stellaire explosive, permet la formation des noyaux lourds. Lors de la désintégration radioactive du noyau de cobalt { }_{27}^{56} \mathrm{Co}, du fer { }_{26}^{56} \mathrm{Fe} et une autre particule se forment.
Sachant que le nombre total de nucléons et de charges se conservent au cours de la réaction, déterminer si la particule formée est un électron {}_{-1}^{\enspace0} \mathrm{e}^{-}, un positon { }_{1}^{0} \mathrm{e}^{+}, un noyau d'hélium { }_{2}^{4} \mathrm{He}, un proton { }_{1}^{1} \mathrm{p} ou un neutron { }_{0}^{1} \mathrm{n}.
1. La synthèse des noyaux plus lourds est réalisée grâce aux réactions nucléaires. Expliquer pourquoi cette synthèse ne peut pas se produire à partir de réactions chimiques.
a. { }_{1}^{1} \mathrm{H}+{ }_{1}^{1} \mathrm{H} \longrightarrow{ }_{1}^{2} \mathrm{H}+{ }_{1}^{0} \mathrm{e}^{+}
b. { }_{1}^{1} \mathrm{H}+{ }_{1}^{2} \mathrm{H} \longrightarrow{ }_{2}^{3} \mathrm{He}+\gamma
c. { }_{2}^{3} \mathrm{He}+{ }_{2}^{3} \mathrm{He} \rightarrow{ }_{2}^{4} \mathrm{He}+{ }_{1}^{0} \mathrm{e}^{+}
À partir d'une combinaison des équations précédentes, retrouver le bilan de la réaction de formation des noyaux d'hélium à partir de noyaux d'hydrogène.
{ }_{2}^{4} \mathrm{He}+{ }_{2}^{4} \mathrm{He} \longrightarrow{ }_{4}^{8} \mathrm{Be}
Préciser si cette réaction est une réaction de fusion ou de fission. Justifier la réponse.Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
