Physique-Chimie Cycle 4
Nouveau manuel de Sciences et Technologie 6e
Découvrez cet ouvrage collaboratif, conforme au nouveau programme !
Mes Pages
Thème 1 - Organisation et transformations de la matière
Ch. 1
L'eau que nous buvons est-elle pure ?
Ch. 2
La matière : états, masse et volume
Ch. 3
Les changements d'état de la matière
Ch. 4
Les mélanges
Ch. 5
La matière à l'échelle microscopique
Ch. 6
Que trouve-t-on dans l'air ?
Ch. 7
Les transformations chimiques et la pollution
Ch. 8
Modélisation des transformations chimiques
Ch. 9
Les ions dans notre quotidien
Ch. 10
Quand les acides et les bases réagissent
Ch. 11
Introduction à la masse volumique
Ch. 12
La masse volumique
Ch. 13
La matière, dans l'espace et dans l'Univers
Ch. 14
De l'Univers aux atomes
Thème 2 - Mouvement et interactions
Ch. 15
Introduction à la vitesse et au mouvement
Ch. 16
Repérage de mouvement et mesure de vitesse
Ch. 17
Vitesse et mouvement
Ch. 18
Les interactions
Ch. 19
Les forces
Ch. 20
Le poids
Thème 3 - L'énergie et ses conversions
Ch. 21
Introduire la notion d'énergie
Ch. 22
Conversion et transfert de l'énergie
Ch. 23
La conservation de l'énergie
Ch. 24
Les circuits électriques
Ch. 25
La tension et l'intensité
Ch. 26
Relations entre grandeurs dans les circuits électriques
Ch. 27
Résistance et loi d'Ohm
Ch. 28
Puissance et énergie en électricité
Thème 4 - Des signaux pour observer et communiquer
Ch. 29
Le son
Ch. 30
La lumière
Ch. 31
Vitesse de propagation des signaux
Ch. 32
Des signaux au-delà de la perception humaine
Chapitre 2
La Physique-Chimie autrement
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Histoire des sciencesLavoisier à l'assaut de l'air
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Lavoisier, un scientifique aux méthodes nouvelles.
Antoine-Laurent de Lavoisier possède un esprit curieux et ouvert. Il s'intéresse à tous les domaines, de l'astronomie à la biologie, en passant par le droit et la météorologie. Il correspond régulièrement avec les grands scientiques européens : il est donc informé des découvertes les plus récentes et des idées les plus neuves. Sa fortune lui permet d'équiper un laboratoire très moderne dont l'élément majeur est une balance de précision : c'est en pesant systématiquement tous les composés qu'il révolutionnera peu à peu la chimie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
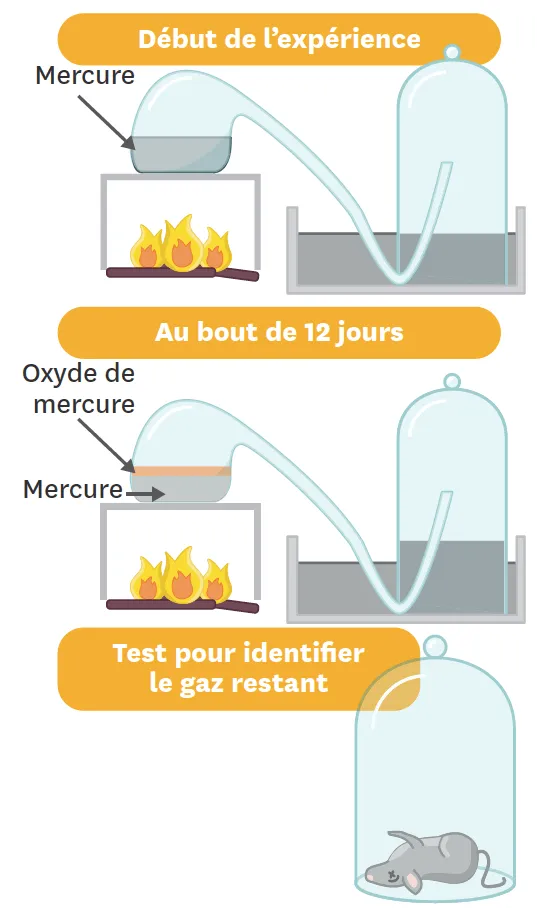
Doc. 2Expérience de Lavoisier inspirée des travaux de J. Priestley.
Lavoisier refait en 1775 une expérience mise au point par le britannique Joseph Priestley et en tire des conclusions novatrices. Il fait bouillir 122,4 g de mercure dans une cornue reliée à une cloche à mercure contenant 0,85 L d'air (voir le schéma). Peu à peu, de l'oxyde rouge de mercure se forme et le niveau d'eau monte sous la cloche (le gaz occupe 0,17 L de moins qu'au départ). Au bout de 12 jours, plus aucune évolution n'est visible et il reste du mercure non oxydé. Lavoisier coupe le chauffage et récupère le gaz restant sous la cloche : ce gaz ne permet pas à une souris de respirer.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Schématisation de l'expérience de Lavoisier.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Célèbre chimiste français, Antoine-Laurent de Lavoisier (1743-1794) fut le premier à comprendre que l'air n'est pas un corps pur mais un mélange de plusieurs gaz. Dans l'Europe des Lumières, il utilise les dernières innovations techniques pour mener ses expériences et bâtir une nouvelle approche de l'étude de la matière.
1. Quelles habitudes de travail faisaient de Lavoisier un scientifique moderne ?
2. Saurais-tu prouver à partir de cette expérience, comme l'a fait Lavoisier, que l'air est fait principalement de deux gaz ? Comment ferais-tu ?
3. Au XVIIIe siècle, les deux gaz de l'air étaient nommés « air vital » (celui qui a oxydé le mercure) et « air déphlogistiqué » (celui qui reste sous la cloche). Peux-tu retrouver leurs noms modernes ?
4. \dfrac{1}{5}, \dfrac{2}{5}, \dfrac{3}{5} … : quelle proportion représente le gaz qui manque sous la cloche ?
1. Quelles habitudes de travail faisaient de Lavoisier un scientifique moderne ?
2. Saurais-tu prouver à partir de cette expérience, comme l'a fait Lavoisier, que l'air est fait principalement de deux gaz ? Comment ferais-tu ?
3. Au XVIIIe siècle, les deux gaz de l'air étaient nommés « air vital » (celui qui a oxydé le mercure) et « air déphlogistiqué » (celui qui reste sous la cloche). Peux-tu retrouver leurs noms modernes ?
4. \dfrac{1}{5}, \dfrac{2}{5}, \dfrac{3}{5} … : quelle proportion représente le gaz qui manque sous la cloche ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objet d'étudeD'un mélange à l'autre, pour des écrans à toute épreuve
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Les écrans ne résistent pas toujours aux chocs qu'ils subissent.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Élaboration d'un verre plus résistant.
De nombreux matériaux sont nommés « verre ». Le dioxyde de silicium pur bien sûr, mais aussi la plupart des mélanges dans lesquels on le retrouve avec des corps ajoutés, tels que les oxydes de sodium ou de calcium. En ajoutant également de petites quantités d'aluminium et en enlevant une partie du sodium pour le remplacer par du potassium, on parvient à fabriquer un nouveau verre désormais très utilisé pour les tablettes et smartphones : le gorilla glass.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
La surface vitrée de nos écrans tactiles est soumise à rude épreuve en cas de chute. Quelle sorte de corps chimique est le verre ? Comment celui des écrans de nos téléphones est-il rendu plus résistant ?
1. Le verre est transparent mais peut-on pour autant dire que c'est un corps pur ?
2. Gorilla glass : voilà un drôle de nom ! Quel message veut-on faire passer avec cette appellation ?
1. Le verre est transparent mais peut-on pour autant dire que c'est un corps pur ?
2. Gorilla glass : voilà un drôle de nom ! Quel message veut-on faire passer avec cette appellation ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La Physique-Chimie au quotidienEsprit scientifique
Un nuage dans une bouteille ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Une bouteille d'eau pétillante en plastique, vide, propre et sans étiquette.
- Une pompe à vélo.
- Une valve de chambre à air adaptée sur le bouchon de la bouteille d'eau pétillante, ou un bouchon de fusée à eau.
- De l'alcool à bruler.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
L'alcool à bruler s'évapore et ses particules se mélangent à celles qui composent l'air sous pression. À l'ouverture de la bouteille, la pression et la température de ce mélange de gaz diminuent, ce qui liquéfie les vapeurs d'alcool en de minuscules gouttelettes partout dans la bouteille. C'est donc un nuage d'alcool que tu vois !
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Étapes de la fabrication :
- Verse un tout petit fond d'alcool à bruler dans la bouteille de soda vide.
- Ferme la bouteille avec son bouchon à valve de vélo, puis ajoute de l'air dans la bouteille avec la pompe à vélo.
- Lorsque la bouteille est devenue bien dure, déconnecte la pompe, agite-la un peu, puis dévisse le bouchon d'un coup.
Des questions à se poser :
1. L'alcool est un liquide volatile qui s'évapore facilement. Que peut-on supposer concernant les particules qui composent le gaz à l'intérieur la bouteille ?2. À l'ouverture de la bouteille, comment évolue la pression dans la bouteille ? Quel effet cela a-t-il sur les vapeurs d'alcool ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
