Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Chapitre 1
Activité 2 - Activité expérimentale
60 min
Libération des ions hydrogène \text{H}^+
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objectif : Représenter le schéma de Lewis et la formule semi‑développée d'espèce classique.
Identifier le caractère amphotère d'une espèce.
Identifier le caractère amphotère d'une espèce.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Un acide selon Brönsted est une espèce pouvant libérer un ion \text{H}^+. Or, toutes les espèces comportant des atomes d'hydrogène ne sont pas forcément des acides.
Pourquoi certaines espèces libèrent‑elles des ions hydrogène \text{H}^+, nommés aussi « protons » ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Familles des amines
Une amine est un composé organique dérivé de l'ammoniac dont au moins un atome d'hydrogène a été remplacé par un groupe carboné. Si l'un des atomes de carbone liés à l'atome d'azote fait partie d'un groupe carbonyle, la molécule appartient à la famille des amides. Découvertes en 1849 par Wurtz, les amines ont été initialement appelées « alcaloïdes artificiels ».
On parle d'amine primaire, secondaire ou tertiaire selon qu'il y a un, deux ou trois [...] groupements [carbonés], liés à l'atome d'azote. Par exemple, la triméthylamine [...] est une amine tertiaire, de formule \text{N(CH}_3)_3, car trois groupements méthyle sont liés à l'azote.
On parle d'amine primaire, secondaire ou tertiaire selon qu'il y a un, deux ou trois [...] groupements [carbonés], liés à l'atome d'azote. Par exemple, la triméthylamine [...] est une amine tertiaire, de formule \text{N(CH}_3)_3, car trois groupements méthyle sont liés à l'azote.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Polarisation de liaisons
L'électronégativité désigne la capacité d'un atome à attirer des électrons.


Électronégativité \chi de quelques atomes sur l'échelle de Pauling.
Dans une liaison polarisée, les électrons sont déportés vers l'atome le plus électronégatif. Des charges partielles apparaissent alors. Plus la différence d'électronégativité entre les atomes est forte, plus la liaison est polarisée.


Électronégativité \chi de quelques atomes sur l'échelle de Pauling.
Dans une liaison polarisée, les électrons sont déportés vers l'atome le plus électronégatif. Des charges partielles apparaissent alors. Plus la différence d'électronégativité entre les atomes est forte, plus la liaison est polarisée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Acide acétique
L'acide éthanoïque, nommé aussi acide acétique, est à l'origine de l'acidité et de l'odeur du vinaigre.
La molécule d'acide éthanoïque peut libérer un ion \text{H}^+. Comme pour tous les acides, cette libération a lieu en raison de la forte polarisation de la liaison entre un atome d'hydrogène et un atome plus électronégatif.

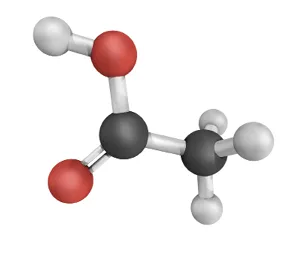


La molécule d'acide éthanoïque peut libérer un ion \text{H}^+. Comme pour tous les acides, cette libération a lieu en raison de la forte polarisation de la liaison entre un atome d'hydrogène et un atome plus électronégatif.




Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Découvrez comment produire du vinaigre à partir de l'acide acétique en .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
RAI/ANA : Lier modèles microscopiques et grandeurs macroscopiques
APP : Extraire l'information utile
APP : Extraire l'information utile
Cliquez pour accéder à une zone de dessin
2. Rappeler la signification du terme « acide » de l'acide acétique. Préciser quel est l'atome d'hydrogène responsable du caractère acide. Justifier.
3. En déduire le schéma de Lewis de sa base conjuguée.
Cliquez pour accéder à une zone de dessin
4. Préciser, en le justifiant, si la triméthylamine peut être acide.
5. La triméthylamine a des propriétés basiques. En déduire le schéma de Lewis le plus probable pour son acide conjugué. Justifier.
Cliquez pour accéder à une zone de dessin
6. À partir de son schéma de Lewis, justifier que l'eau peut avoir des propriétés acide et basique. Indiquer le(s) couple(s) acide-base formé(s). Rechercher sur Internet comment nommer une telle espèce.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Préciser comment repérer un site acide ou basique selon Brönsted à partir de la formule chimique d'une espèce.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
