Physique-Chimie 2de
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Identification des espèces chimiques
Ch. 2
Composition des solutions aqueuses
Ch. 3
Dénombrer les entités
Ch. 4
Le noyau de l’atome
Ch. 5
Le cortège électronique
Ch. 6
Stabilité des entités chimiques
Ch. 7
Modélisation des transformations physiques
Ch. 8
Modélisation des transformations chimiques
Ch. 9
Synthèse de molécules naturelles
Ch. 10
Modélisation des transformations nucléaires
2. Mouvement et interactions
Ch. 11
Décrire un mouvement
Ch. 12
Modéliser une action sur un système
Ch. 13
Principe d’inertie
3. Ondes et signaux
Ch. 14
Émission et perception d’un son
Ch. 15
Analyse spectrale des ondes lumineuses
Ch. 16
Propagation des ondes lumineuses
Ch. 17
Signaux et capteurs
Méthode
Fiches méthode
Fiches méthode compétences
Annexes
Chapitre 5
Activité 2 - Activité d'exploration
Des électrons bien ordonnés ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
D'après le modèle de Bohr, les électrons gravitent autour du noyau dans des orbites situées à des distances du noyau bien précises.
Comment les électrons se répartissent-ils autour du noyau ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Quel peut être le point commun entre la disposition des spectateurs dans un stade et celle des électrons dans l'atome ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
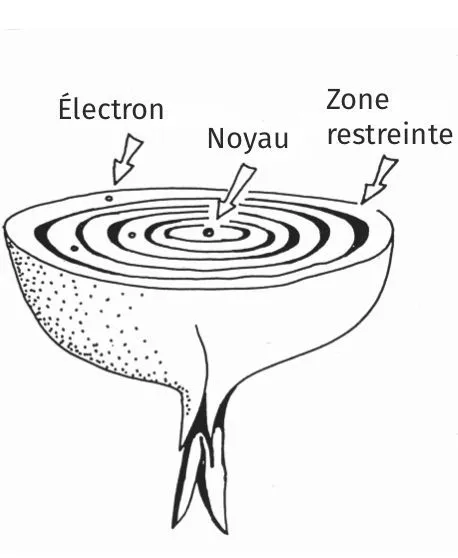
Doc. 1 Modèle de Bohr et mécanique quantique
Les électrons ne se disposent pas au hasard autour du noyau. En 1913, Niels Bohr suppose qu'ils se situent à des distances particulières. Les zones dans lesquelles on peut trouver les électrons se nomment couches et sous-couches. On les repère à l'aide de chiffres et de lettres.
Les couches sont représentées par un entier positif n. La première couche correspond à n = 1, la deuxième à n = 2, etc. Chaque couche possède une ou plusieurs sous-couches représentées par la lettre l à laquelle sont associées une valeur puis une autre lettre. La première sous-couche se note s (l = 0), la deuxième p (l= 1) et la troisième (l= 2) se note d.
Par exemple, si n = 3 et l = 2 on parle de la sous-couche 3d.
Sur une orbite donnée, les éléctrons ont une énergie donnée. On parle donc de niveau d'énergie pour chaque sous-couche.
Les couches sont représentées par un entier positif n. La première couche correspond à n = 1, la deuxième à n = 2, etc. Chaque couche possède une ou plusieurs sous-couches représentées par la lettre l à laquelle sont associées une valeur puis une autre lettre. La première sous-couche se note s (l = 0), la deuxième p (l= 1) et la troisième (l= 2) se note d.
Par exemple, si n = 3 et l = 2 on parle de la sous-couche 3d.
Sur une orbite donnée, les éléctrons ont une énergie donnée. On parle donc de niveau d'énergie pour chaque sous-couche.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Nombre d'électrons maximum
La couche n peut contenir 2n^{2} électrons. Ces électrons se répartissent sur n sous-couches.
La sous-couche l peut contenir 2l + 1 paires d'électrons c'est-à-dire 2(2l + 1) électrons.
Par exemple, la sous-couche 3s (n = 3 et l = 0) peut contenir 2(2 \times 0 + 1) = 2 électrons au maximum.
La sous-couche l peut contenir 2l + 1 paires d'électrons c'est-à-dire 2(2l + 1) électrons.
Par exemple, la sous-couche 3s (n = 3 et l = 0) peut contenir 2(2 \times 0 + 1) = 2 électrons au maximum.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Remplir les couches et les sous-couches


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
MOD : Connaître la structure du nuage électronique
2. Doc. 1 et 2 Combien d'électrons peuvent contenir les sous-couches 1s, 2s et 2p ?
Doc. 3 À l'aide de l'exemple de l'aluminium, écrire la configuration électronique du bore _{5}\text{B}, du carbone _{6}\text{C} et du silicium _{14}\text{Si}.
4. Quels sont les points communs et les différences entre ces quatre configurations ?
5. Où se trouvent les éléments bore, carbone, aluminium et silicium dans la classification périodique ? Préciser les numéros de lignes et de colonnes correspondants.
6. Peut-on prévoir la position d'un atome dans la classification grâce à sa configuration électronique et inversement ?
7. Vérifier alors les hypothèses faites à la question Par intuition.
5. Où se trouvent les éléments bore, carbone, aluminium et silicium dans la classification périodique ? Préciser les numéros de lignes et de colonnes correspondants.
6. Peut-on prévoir la position d'un atome dans la classification grâce à sa configuration électronique et inversement ?
7. Vérifier alors les hypothèses faites à la question Par intuition.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Comment écrit-on la configuration électronique d'un atome ? Comment utiliser la classification périodique pour prévoir (ou vérifier) la configuration électronique d'un atome ?
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
