Chapitre 6
Cours
De la structure à la polarité d'une entité
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1 Établir un schéma de Lewis
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Les règles du duet et de l'octet
Dans une molécule, les atomes sont liés par des liaisons covalentes obtenues par la mise en commun d'électrons. Leur couche électronique externe est alors saturée, et leur stabilité est plus grande que lorsqu'ils sont isolés.
Dans une molécule, chaque atome respecte la règle du duet ou la règle de l'octet. Les formules de Lewis des molécules permettent de vérifier le respect de ces règles en comptabilisant les électrons des liaisons covalentes et des doublets non liants pour chaque atome de la molécule.
Voir l'exemple de la molécule d'eau ().
Dans une molécule, chaque atome respecte la règle du duet ou la règle de l'octet. Les formules de Lewis des molécules permettent de vérifier le respect de ces règles en comptabilisant les électrons des liaisons covalentes et des doublets non liants pour chaque atome de la molécule.
Voir l'exemple de la molécule d'eau ().
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Le schéma de Lewis de \mathrm{H}_{2} \mathrm{O}

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Établir un schéma de Lewis
Une méthode possible pour établir le schéma du modèle de Lewis d'une molécule à partir de sa formule brute consiste à :
1) écrire la configuration électronique de chaque atome ;
2) déterminer le nombre total d'électrons de valence n_{t} mis en jeu dans la molécule étudiée ;
3) déterminer le nombre de doublets d'électrons (impliqués dans des liaisons covalentes ou des doublets non liants) en divisant le nombre n_{t} par deux ;
4) répartir les doublets en respectant les règles du duet (pour \mathrm{H} et de l'octet pour les autres atomes. Chaque atome forme un nombre de liaisons covalentes égal au nombre d'électrons manquant pour respecter la règle de l'octet ou du duet.
Exemple : la molécule d'ammoniac \mathrm{NH}_{3} :
1) écrire la configuration électronique de chaque atome ;
2) déterminer le nombre total d'électrons de valence n_{t} mis en jeu dans la molécule étudiée ;
3) déterminer le nombre de doublets d'électrons (impliqués dans des liaisons covalentes ou des doublets non liants) en divisant le nombre n_{t} par deux ;
4) répartir les doublets en respectant les règles du duet (pour \mathrm{H} et de l'octet pour les autres atomes. Chaque atome forme un nombre de liaisons covalentes égal au nombre d'électrons manquant pour respecter la règle de l'octet ou du duet.
Exemple : la molécule d'ammoniac \mathrm{NH}_{3} :
| Molécule | Ammoniac \mathrm{NH}_{3} | |||
| Atomes | \mathrm{H} | \mathrm{H} | \mathrm{H} | \mathrm{N} |
| Configuration électronique | 1s1 | 1s1 | 1s1 | 1s22s22p3 |
| Électrons de valence (couche externe) | 1 | 1 | 1 | 5 |
| Nombre d'électrons manquant pour respecter la règle du duet (\text{H}) et la règle de l'octet (\text{N}) | 1 | 1 | 1 | 3 |
| n_{\mathrm{t}} | 1+1+1+5=8 | |||
| Nombre de doublets | \dfrac{8}{2}=4 | |||
| Répartition des doublets et nature des doublets | 3 liaisons
covalentes entre \mathrm{H} et \mathrm{N} 1 doublet non liant sur \mathrm{N}  | |||
Remarque
Chaque liaison covalente simple formée par un atome avec un autre lui permet de gagner un électron sur sa couche externe.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
➜ Il faut comptabiliser tous les électrons des liaisons dans lesquelles chaque atome est impliqué.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Le modèle de Lewis ne s'intéresse pas aux électrons internes, seulement aux électrons de la couche de valence (ou couche externe), car seuls ceux-ci peuvent établir des liaisons covalentes.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Liaison covalente : mise en commun de deux électrons de valence entre deux atomes. On représente une liaison covalente par un tiret entre les 2 atomes concernés :
- Doublets non liants : pour un atome, ce sont des paires d'électrons de la couche externe qui ne participent pas aux liaisons covalentes.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C Pour aller plus loin : les acides de Lewis
Certaines entités chimiques possèdent une lacune électronique,
symbolisée par un rectangle vide. On appelle ces entités chimiques des acides de Lewis.
Les atomes porteurs de la lacune électronique au sein de ces entités ne respectent pas la règle de l'octet, ou du duet, et sont donc susceptibles de créer une liaison covalente avec un doublet non liant d'une autre molécule.
Les atomes porteurs de la lacune électronique au sein de ces entités ne respectent pas la règle de l'octet, ou du duet, et sont donc susceptibles de créer une liaison covalente avec un doublet non liant d'une autre molécule.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Un acide de Lewis, le borane
Dans le borane, le bore possède une lacune électronique représentée par un rectangle vide.
Il ne respecte pas la règle de l'octet car il est entouré de 6 électrons (3 liaisons covalentes).
Il ne respecte pas la règle de l'octet car il est entouré de 6 électrons (3 liaisons covalentes).

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2 La géométrie spatiale des molécules
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A De la formule de Lewis à la géométrie des molécules
On peut prévoir la géométrie d'une entité chimique à partir de sa structure de Lewis.
Autour d'un atome qualifié de central, les doublets liants, ou doublets des liaisons covalentes, et les doublets non liants s'écartent au maximum des uns des autres afin de minimiser les forces de répulsions électrostatiques.
Les géométries adoptées sont des formes géométriques simples :
Autour d'un atome qualifié de central, les doublets liants, ou doublets des liaisons covalentes, et les doublets non liants s'écartent au maximum des uns des autres afin de minimiser les forces de répulsions électrostatiques.
Les géométries adoptées sont des formes géométriques simples :
| Nombre de liaisons (simples ou doubles) et de doublets non liants | 2 liaisons simples | 2 liaisons et 1 liaison double | 4 liaisons simples |
| Géométrie autour de l'atome central | Linéaire | Plane trigonale | Tétraédrique |
| Représentation spatiale |  |  |  |
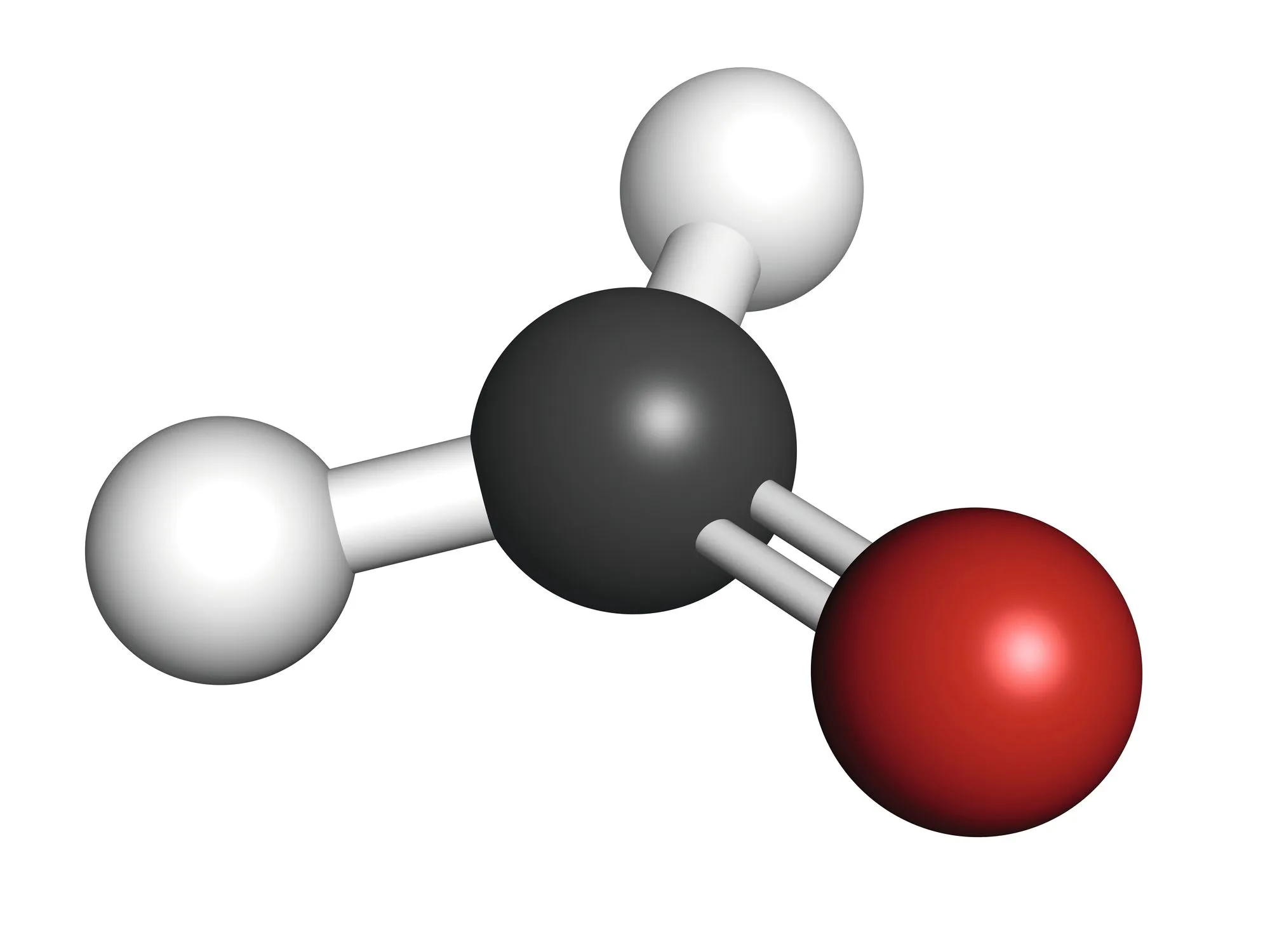
| Exemple | Dioxyde de carbone \mathrm{CO}_{2}  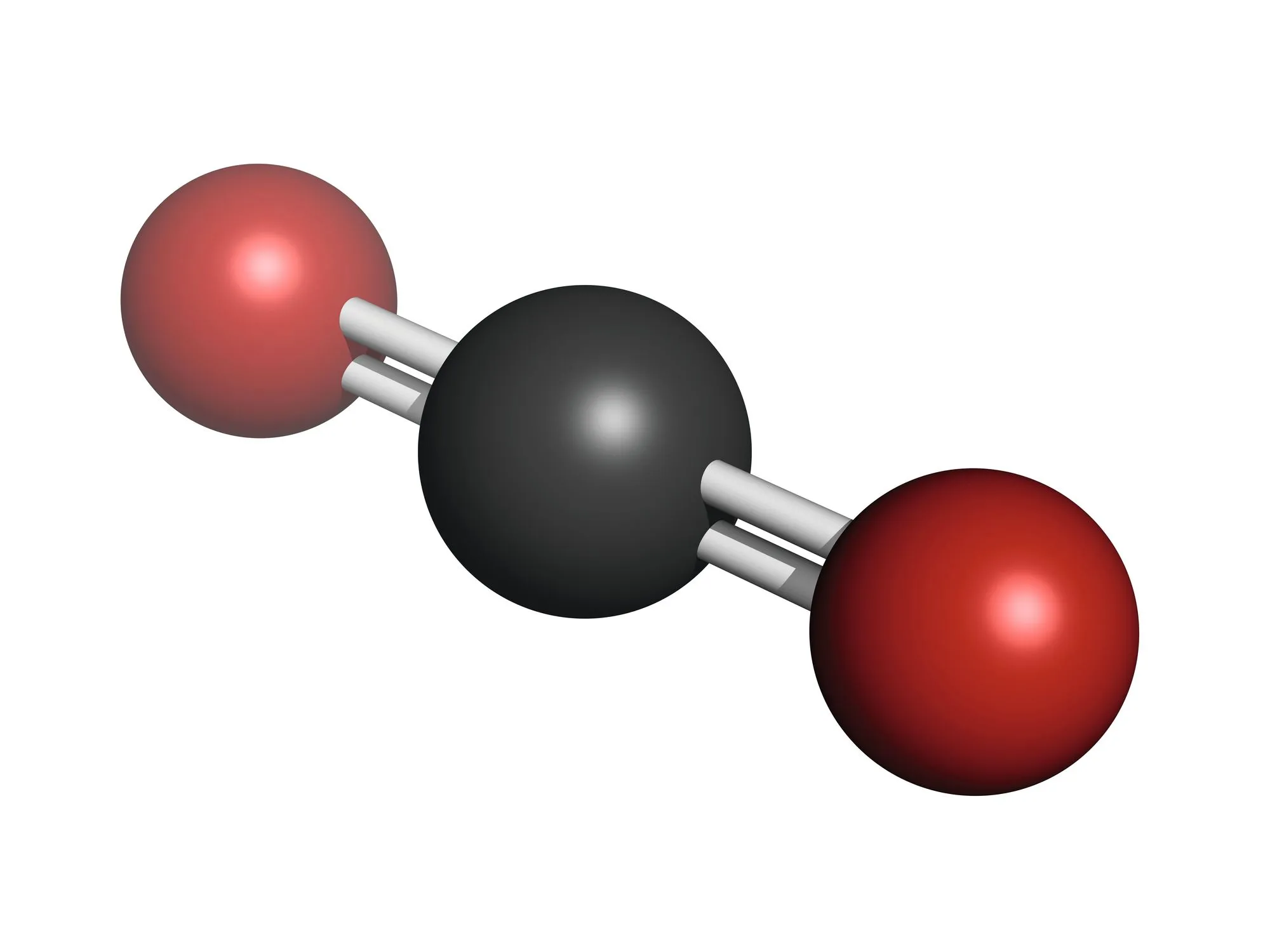 | Méthanal \mathrm{CH}_{2} \mathrm{O}
  | Méthane \mathrm{CH}_{4}
 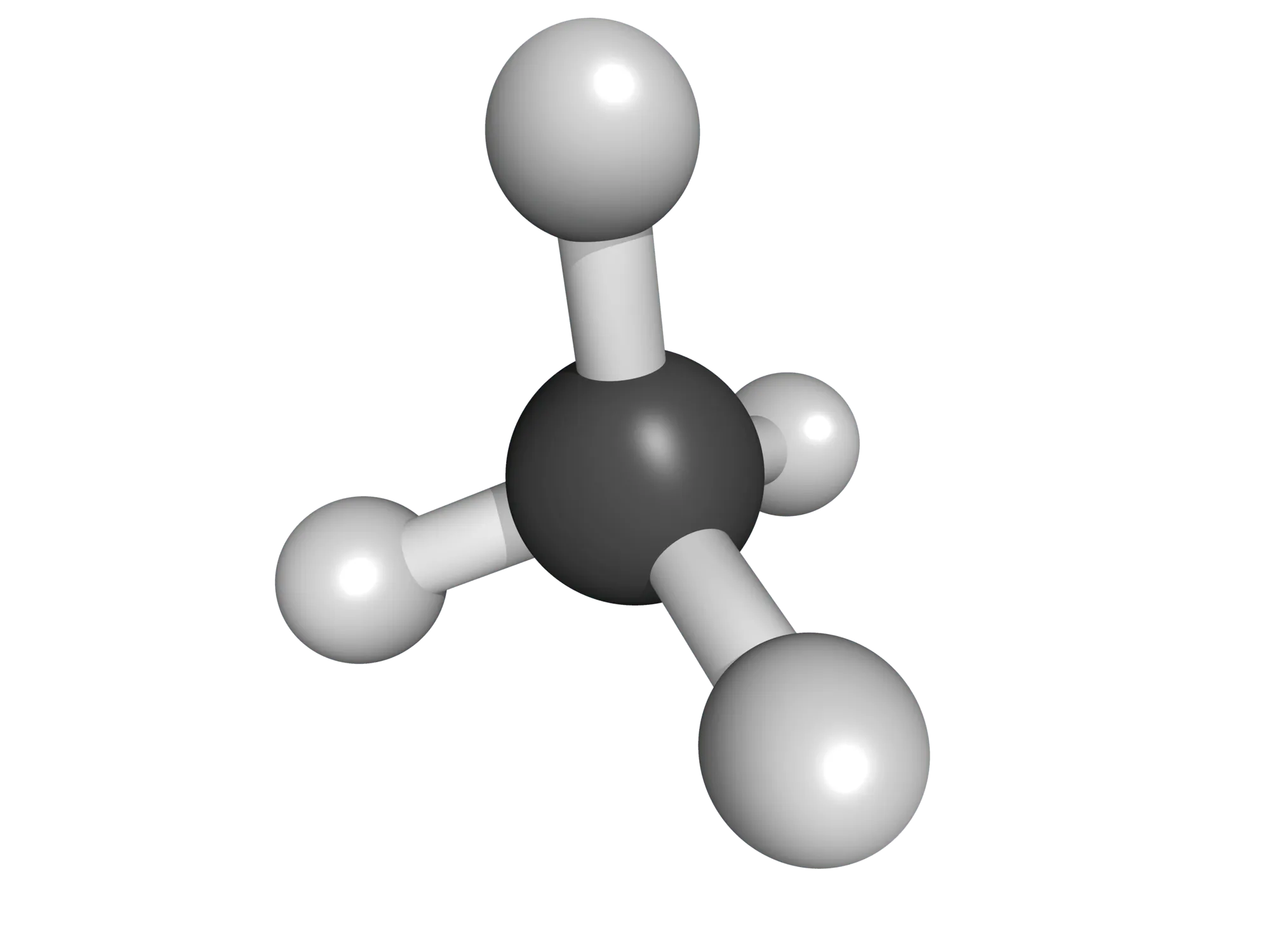 |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
➜ On parle de l'atome central quand on cherche à identifier la géométrie d'une entité chimique. Il s'agit de l'atome autour duquel les liaisons covalentes et les doublets non liants se répartissent.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
➜ Une liaison multiple, double ou triple, est traitée comme une liaison simple pour déterminer la géométrie d'une espèce chimique.
➜ Dans le cas d'une entité ne comportant que deux atomes, la géométrie est nécessairement linéaire.
➜ Dans le cas d'une entité ne comportant que deux atomes, la géométrie est nécessairement linéaire.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
➜ Dans le cas de la molécule d'eau, on parle de géométrie coudée car l'atome d'oxygène possède 2 doublets non liants et forme deux liaisons covalentes, soit 4 doublets au total mis en jeu.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Pour aller plus loin : la théorie VSEPR
La théorie VSEPR, dont le nom est issu du sigle anglais valence shell electron pair repulsion, s'inscrit dans la poursuite de la théorie développée par Gilbert Lewis en 1916 sur les liaisons chimiques. Le formalisme de cette méthode est plus abouti mais il n'est pas au programme. On appelle aussi parfois ce modèle le modèle de Gillespie, du chimiste qui l'a étudié.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Représentation VSEPR

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Application
À partir de la représentation de Lewis de la molécule d'eau, indiquer la géométrie adoptée.
Corrigé :
L'atome d'oxygène, considéré comme central, possède 2 doublets non liants et 2 liaisons covalentes, soit 4 doublets électroniques.
Cet atome est donc au centre d'un tétraèdre dont chaque sommet est occupé soit par un atome d'hydrogène, soit par un doublet non liant. On dit que la molécule d'eau est coudée ().
Corrigé :
L'atome d'oxygène, considéré comme central, possède 2 doublets non liants et 2 liaisons covalentes, soit 4 doublets électroniques.
Cet atome est donc au centre d'un tétraèdre dont chaque sommet est occupé soit par un atome d'hydrogène, soit par un doublet non liant. On dit que la molécule d'eau est coudée ().
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Représentation de Lewis de \mathrm{H}_{2} \mathrm{O} :

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4 Molécules coudée et pyramidale

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3 La polarité des molécules
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A De l'électronégativité d'un atome à une liaison covalente polarisée
L'électronégativité d'un atome traduit son aptitude à attirer à lui
les électrons d'une liaison dans laquelle il est engagé. Cette grandeur sans unité varie en fonction de la place de l'élément chimique dans le tableau périodique.
Dans une liaison covalente entre deux atomes \text{A} et \text{B}, si l'atome \text{A} est plus électronégatif que l'atome \text{B}, la liaison \text{A} - \text{B} est dite polarisée. Elle est alors notée \text{A}^{\delta-}-\text{B}^{\delta+}.
Les symboles \delta+ et \delta- traduisent les charges partielles portées par les atomes de cette liaison covalente : \text{A} étant plus électronégatif, il porte une charge partielle négative notée \delta-, \text{B} porte alors une charge partielle positive notée \delta+.
Dans une liaison covalente entre deux atomes \text{A} et \text{B}, si l'atome \text{A} est plus électronégatif que l'atome \text{B}, la liaison \text{A} - \text{B} est dite polarisée. Elle est alors notée \text{A}^{\delta-}-\text{B}^{\delta+}.
Les symboles \delta+ et \delta- traduisent les charges partielles portées par les atomes de cette liaison covalente : \text{A} étant plus électronégatif, il porte une charge partielle négative notée \delta-, \text{B} porte alors une charge partielle positive notée \delta+.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
➜ On parle d'une liaison polarisée ou non polarisée, et d'une molécule polaire ou apolaire.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5 Électronégativité x de quelques atomes

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Prévoir la polarité d'une molécule
Pour déterminer le caractère polaire d'une molécule, il faut s'intéresser à l'électronégativité des atomes qui la constituent, identifier les éventuelles liaisons polarisées et enfin s'intéresser à la géométrie de la molécule.
Une molécule peut être polaire si elle comporte au moins une liaison polarisée :
Exemple : La molécule d'eau est polaire (voir ) alors que la molécule de dioxyde de carbone ne l'est pas.
En effet, sur le schéma ci-dessous, les polarisations des 2 liaisons C=0 se compensent et s'annulent.

Une molécule peut être polaire si elle comporte au moins une liaison polarisée :
- si elle ne comporte qu'une seule liaison polarisée, elle est alors nécessairement polaire ;
- si elle comporte plusieurs liaisons polarisées, il faut alors étudier la géométrie de cette molécule pour s'assurer que les polarisations des liaisons ne se compensent pas.
Exemple : La molécule d'eau est polaire (voir ) alors que la molécule de dioxyde de carbone ne l'est pas.
En effet, sur le schéma ci-dessous, les polarisations des 2 liaisons C=0 se compensent et s'annulent.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
➜ Une charge partielle, positive ou négative, n'est pas une charge réelle comme dans un cation ou un anion. Il s'agit d'une grandeur uniquement formelle pour traduire la polarisation de la liaison.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 6 L'eau, une molécule polaire
La molécule d'eau possède 2 liaisons \mathrm{O}-\mathrm{H} polarisées :

La géométrie coudée de cette molécule impose des charges partielles positives et négatives.


La géométrie coudée de cette molécule impose des charges partielles positives et négatives.

Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille


