Physique-Chimie Cycle 4
Nouveau manuel de Sciences et Technologie 6e
Découvrez cet ouvrage collaboratif, conforme au nouveau programme !
Mes Pages
Thème 1 - Organisation et transformations de la matière
Ch. 1
L'eau que nous buvons est-elle pure ?
Ch. 2
La matière : états, masse et volume
Ch. 3
Les changements d'état de la matière
Ch. 4
Les mélanges
Ch. 5
La matière à l'échelle microscopique
Ch. 6
Que trouve-t-on dans l'air ?
Ch. 7
Les transformations chimiques et la pollution
Ch. 8
Modélisation des transformations chimiques
Ch. 9
Les ions dans notre quotidien
Ch. 10
Quand les acides et les bases réagissent
Ch. 11
Introduction à la masse volumique
Ch. 12
La masse volumique
Ch. 13
La matière, dans l'espace et dans l'Univers
Ch. 14
De l'Univers aux atomes
Thème 2 - Mouvement et interactions
Ch. 15
Introduction à la vitesse et au mouvement
Ch. 16
Repérage de mouvement et mesure de vitesse
Ch. 17
Vitesse et mouvement
Ch. 18
Les interactions
Ch. 19
Les forces
Ch. 20
Le poids
Thème 3 - L'énergie et ses conversions
Ch. 21
Introduire la notion d'énergie
Ch. 22
Conversion et transfert de l'énergie
Ch. 23
La conservation de l'énergie
Ch. 24
Les circuits électriques
Ch. 25
La tension et l'intensité
Ch. 26
Relations entre grandeurs dans les circuits électriques
Ch. 27
Résistance et loi d'Ohm
Ch. 28
Puissance et énergie en électricité
Thème 4 - Des signaux pour observer et communiquer
Ch. 29
Le son
Ch. 30
La lumière
Ch. 31
Vitesse de propagation des signaux
Ch. 32
Des signaux au-delà de la perception humaine
Chapitre 3
Activité 4 - Tâche complexe
Une protection bidon ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Compétences : Mettre en oeuvre un raisonnement logique simple pour résoudre un problème.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Introduction


Le zinc est un métal utilisé pour prolonger la durée d'utilisation des objets en fer ou en acier. Lors d'un procédé appelé galvanisation, une mince couche de zinc est déposée à la surface du fer et retarde sa dégradation chimique. Utilisés en grande quantité dans les industries, les produits ménagers peuvent être stockés dans des bidons en acier galvanisé.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Action de l'acide sulfurique sur le zinc.


On observe un dégagement gazeux. Ce gaz donne une petite détonation à l'approche d'une flamme.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Tests d'identification réalisés sur la solution obtenue à la fin de la réaction (voir significations au chapitre précédent).


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Espèces chimiques et formules.
| Ion sulfate | SO42- |
| Atome de zinc | Zn |
| Ion zinc | Zn2+ |
| Dihydrogène | H2 |
| Ion hydrogène | H+ |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4Évolution du pH de la solution obtenue au cours de la réaction.

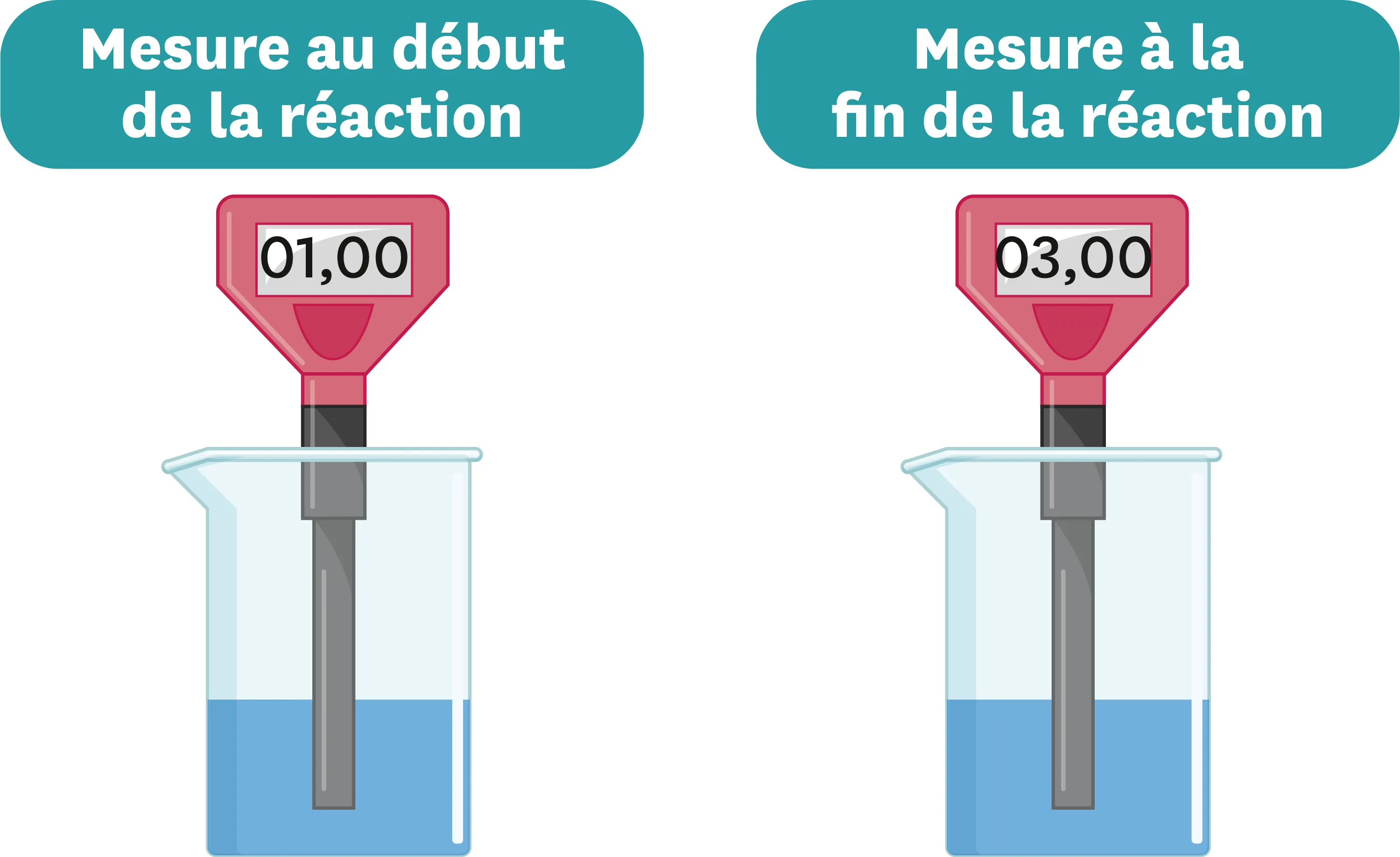
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ta mission
Pourquoi la couche de zinc déposée à la surface du bidon ne fait-elle que retarder la corrosion ? À partir des documents, détermine si ce métal est concerné par la corrosion et écris l'équation de réaction qui correspond si c'est le cas.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- J'ai associé les différents tests présentés aux espèces chimiques correspondantes.
- J'ai identifié les espèces chimiques dont les quantités ont changé.
- J'ai expliqué pourquoi le zinc ne fait que retarder la corrosion du fer et de l'acier.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
