Physique-Chimie 2de
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Identification des espèces chimiques
Ch. 2
Composition des solutions aqueuses
Ch. 3
Dénombrer les entités
Ch. 4
Le noyau de l’atome
Ch. 5
Le cortège électronique
Ch. 6
Stabilité des entités chimiques
Ch. 7
Modélisation des transformations physiques
Ch. 8
Modélisation des transformations chimiques
Ch. 9
Synthèse de molécules naturelles
Ch. 10
Modélisation des transformations nucléaires
2. Mouvement et interactions
Ch. 11
Décrire un mouvement
Ch. 12
Modéliser une action sur un système
Ch. 13
Principe d’inertie
3. Ondes et signaux
Ch. 14
Émission et perception d’un son
Ch. 15
Analyse spectrale des ondes lumineuses
Ch. 16
Propagation des ondes lumineuses
Ch. 17
Signaux et capteurs
Méthode
Fiches méthode
Fiches méthode compétences
Annexes
1re partie : constitution et transformation de la matière
Chapitre 6 : dénombrer les entités
Activité 2 L'électroneutralité à toutes les échelles
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La préparation de solutions ioniques occupe une part importante du temps de travail d'un technicien de laboratoire au lycée.
Comment comptabiliser les éléments ioniques à partir d'une masse de
composé dissout ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Quelques exemples de solutés
Une solution aqueuse s'obtient en introduisant un soluté (solide, liquide ou gaz) dans de l'eau distillée.
Exemple de solutés :
Equation qui modélise la dissolution de \text{CaF}_2 dans l'eau :
Exemple de solutés :
- solide ionique : sel de cuisine (\text{NaCl}) ;
- solide ionique : fluorure de calcium (\text{CaF}_2) ;
- gazeux : chlorure d'hydrogène (\text{HCl}).
Equation qui modélise la dissolution de \text{CaF}_2 dans l'eau :
\mathrm{CaF}_{2}(\mathrm{s}) \rightarrow \mathrm{Ca}^{2+}(\mathrm{aq})+2 \, \mathrm{F}^{-}(\mathrm{aq}).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Formules et masses (en 10-26 kg) de quelques cations (ions positifs) :
\text{H}^+ : 0,167 - ion hydrogène ;
\text{Na}^+ : 3,82 - ion sodium ;
\text{Ca}^{2+} : 6,66 - ion calcium.
Formules et masses (en 10-26 kg) de quelques anions (ions négatifs) :
\text{Cl}^-: 5,89 - ion chlorure ;
\text{F}^- : 3,15 - ion fluorure.
Formules et masses (en 10-26 kg) de quelques anions (ions négatifs) :
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Le sel à l'échelle microscopique
Les solides ioniques ont très souvent une structure dite cristalline. Un cristal se caractérise par une disposition parfaitement ordonnée des ions qui le constituent.
Cette structure est due aux interactions électriques entre ces ions.
Cette structure est due aux interactions électriques entre ces ions.
Ex : \text{NaCl}.

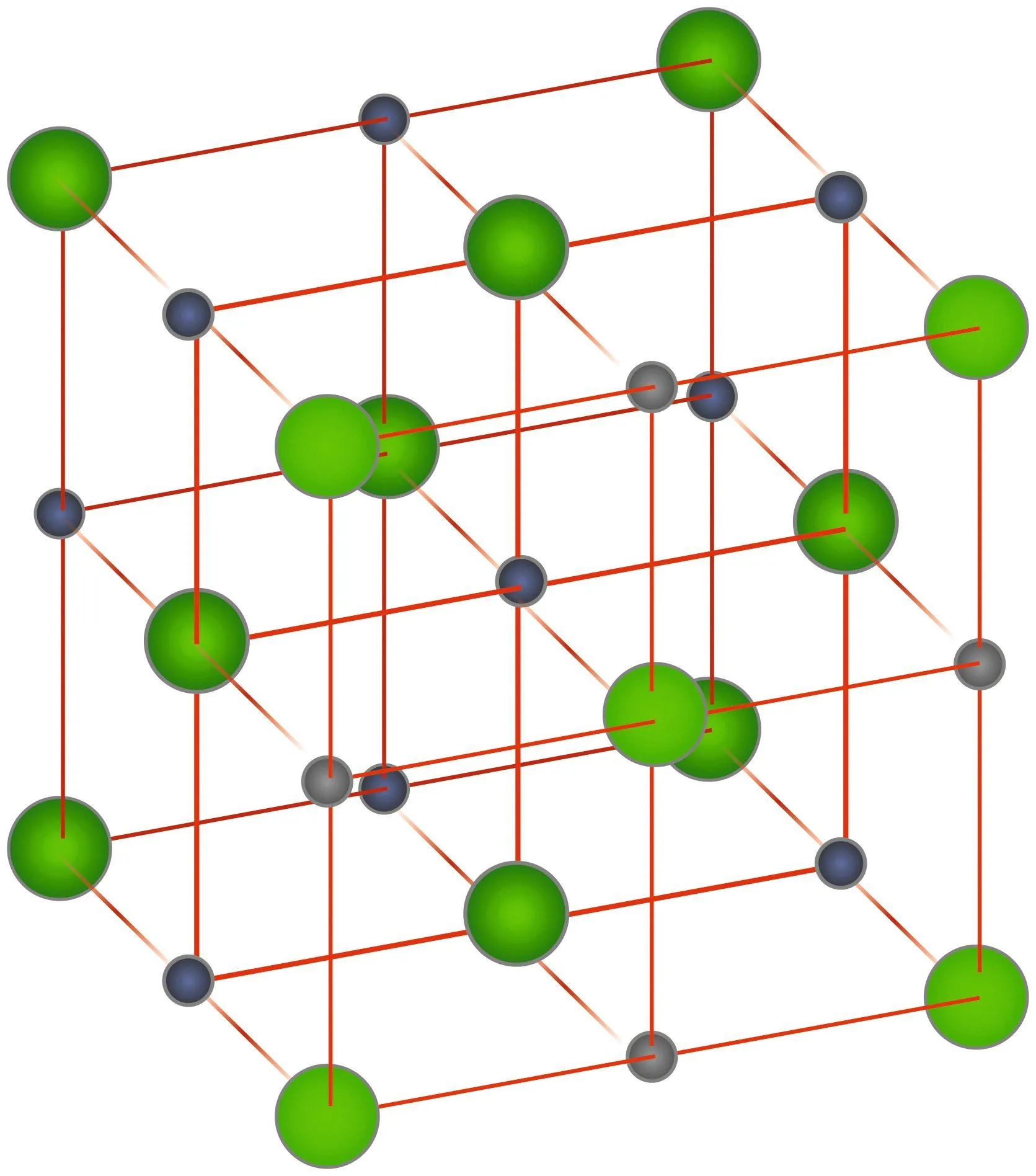
Légende : Na+ : en bleu ; Cl- : en vert.


Légende : Na+ : en bleu ; Cl- : en vert.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Matériel nécessaire


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions - réponses à rédiger sur feuille, un compte-rendu par élève
1. Doc. 1 et 2 Écrire l'équation qui modélise la dissolution du chlorure de sodium NaCl dans l'eau.
2. Doc. 3 Etablir une liste du matériel nécessaire à la préparation d'une eau salée de concentration en masse 70 g/L. Indiquer le calcul permettant de justifier la masse de solide pesé compte tenu du matériel disponible. Effectuer la dissolution.
3. Vérifier votre préparation sachant qu'une solution de chlorure de sodium a une conductivité donnée par la relation :
\sigma(mS.cm^{-1})=1,18\times\gamma(g.L^{-1}).
La conductivité se note σ (sigma) et se mesure au conductimètre.
2. Doc. 3 Etablir une liste du matériel nécessaire à la préparation d'une eau salée de concentration en masse 70 g/L. Indiquer le calcul permettant de justifier la masse de solide pesé compte tenu du matériel disponible. Effectuer la dissolution.
3. Vérifier votre préparation sachant qu'une solution de chlorure de sodium a une conductivité donnée par la relation :
\sigma(mS.cm^{-1})=1,18\times\gamma(g.L^{-1}).
La conductivité se note σ (sigma) et se mesure au conductimètre.
4. Déterminer la quantité d'ions chlorure et d'ions sodium qui sont introduits lors de la préparation de 100 mL de solution à 70 g/L.
5. Reprendre la question 4. pour les autres solutés proposés dans le doc. 1 en déterminant dans chaque cas les quantités d'ions introduits.
5. Reprendre la question 4. pour les autres solutés proposés dans le doc. 1 en déterminant dans chaque cas les quantités d'ions introduits.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
La quantité de cations et la quantité d'anions sont-elles identiques pour respecter l'électroneutralité de la solution ? Justifier.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
