Physique-Chimie 2de
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Identification des espèces chimiques
Ch. 2
Composition des solutions aqueuses
Ch. 3
Dénombrer les entités
Ch. 4
Le noyau de l’atome
Ch. 5
Le cortège électronique
Ch. 6
Stabilité des entités chimiques
Ch. 7
Modélisation des transformations physiques
Ch. 8
Modélisation des transformations chimiques
Ch. 9
Synthèse de molécules naturelles
Ch. 10
Modélisation des transformations nucléaires
2. Mouvement et interactions
Ch. 11
Décrire un mouvement
Ch. 12
Modéliser une action sur un système
Ch. 13
Principe d’inertie
3. Ondes et signaux
Ch. 14
Émission et perception d’un son
Ch. 15
Analyse spectrale des ondes lumineuses
Ch. 16
Propagation des ondes lumineuses
Ch. 17
Signaux et capteurs
Méthode
Fiches méthode
Fiches méthode compétences
Annexes
Chapitre 1
Activité 1 - Histoire des sciences
L'expérience historique de Lavoisier
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
C'est Antoine de Lavoisier, le célèbre chimiste français, qui, en 1777, découvre que l'air est constitué de plusieurs gaz. L'expérience de Lavoisier consiste à faire chauffer du mercure dans une enceinte fermée contenant de l'air et à observer les changements ayant lieu.
Quelles observations ont permis à Lavoisier de déterminer la composition de l'air ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
L'air est un mélange complexe de gaz. Comment pourrait-on le vérifier ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
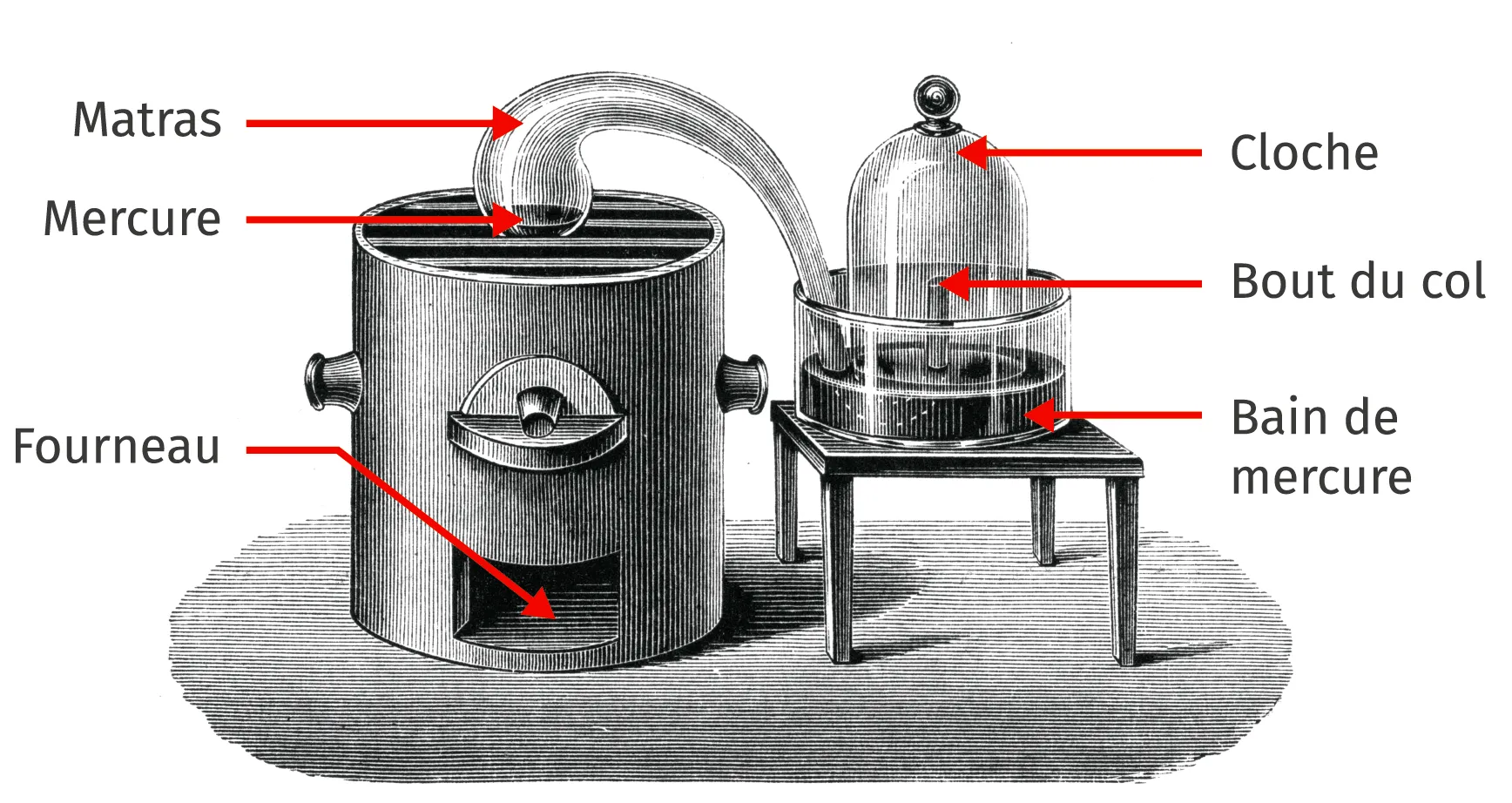
Doc. 1 Une expérience historique
J'ai pris un matras (vase) de 36 pouces cubiques environ de capacité dont le col était très long. Je l'ai courbé de manière qu'il pût être placé dans un fourneau, tandis que l'extrémité de son col irait s'engager sous la cloche, placée dans un bain de mercure. J'ai introduit dans ce matras quatre onces de mercure très pur. [Puis] le mercure fût échauffé presqu'au degré nécessaire pour le faire bouillir.
Le second jour, j'ai commencé à voir nager sur la surface du mercure de petites parcelles rouges*, qui, pendant quatre ou cinq jours ont augmenté en nombre et en volume ; après quoi elles ont cessé de grossir et sont restées absolument dans le même état. Au bout de douze jours, [...] la calcination du mercure ne faisait plus aucun progrès [...].
Le volume de l'air contenu tant dans le matras que dans son col et sous la partie vide de la cloche, réduit à une pression de 28 pouces et à 10 degrés du thermomètre, était avant l'opération de 50 pouces cubiques environ.
Lorsque l'opération a été finie, ce même volume à pression et à température égales, ne s'est plus trouvé que de 42 à 43 pouces : il y avait eu par conséquent une diminution de volume d'un sixième environ.
* Il se produit dans le matras une transformation chimique au cours de laquelle le dioxygène réagit avec le mercure pour former de l'oxyde de mercure HgO, rouge.
Le second jour, j'ai commencé à voir nager sur la surface du mercure de petites parcelles rouges*, qui, pendant quatre ou cinq jours ont augmenté en nombre et en volume ; après quoi elles ont cessé de grossir et sont restées absolument dans le même état. Au bout de douze jours, [...] la calcination du mercure ne faisait plus aucun progrès [...].
Le volume de l'air contenu tant dans le matras que dans son col et sous la partie vide de la cloche, réduit à une pression de 28 pouces et à 10 degrés du thermomètre, était avant l'opération de 50 pouces cubiques environ.
Lorsque l'opération a été finie, ce même volume à pression et à température égales, ne s'est plus trouvé que de 42 à 43 pouces : il y avait eu par conséquent une diminution de volume d'un sixième environ.
* Il se produit dans le matras une transformation chimique au cours de laquelle le dioxygène réagit avec le mercure pour former de l'oxyde de mercure HgO, rouge.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Dans le texte historique de Lavoisier, de nombreuses grandeurs sont données dans des unités qui ne sont
pas celles du système international.
➜ Voir la pour s'entraîner à faire des conversions.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Montage de Lavoisier

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Un chimiste remarquable
Antoine de Lavoisier (1743-1794), est considéré comme le père de la chimie moderne. Avec ses multiples expériences sur l'air, le dioxygène, ou le dioxyde de carbone, il montre que la matière est constituée d'espèces chimiques (même s'il n'emploie pas ce terme), et non de quatre éléments (feu, terre, eau et air) comme les anciens chimistes l'admettaient.
Plus tard, ses expériences ont montré le caractère acide du dioxyde de carbone, et ont abouti à la célèbre loi de conservation de la matière lors d'une réaction chimique : « rien ne se perd, rien ne se crée, tout se transforme ».
Plus tard, ses expériences ont montré le caractère acide du dioxyde de carbone, et ont abouti à la célèbre loi de conservation de la matière lors d'une réaction chimique : « rien ne se perd, rien ne se crée, tout se transforme ».
Découvrez la , un ainsi que la .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
ANA : Faire le lien entre les modèles microscopiques et les grandeurs macroscopiques.
2. L'air est constitué principalement de deux gaz. Quel autre gaz présent dans l'air est encore présent à la fin de l'expérience ?
3. En utilisant les résultats de l'expérience, déterminer le volume d'air qui a disparu et en déduire l'espèce chimique qui s'est transformée, puis la composition en volume de l'air.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Faire une recherche internet sur la composition de l'air. Proposer une explication aux différences avec l'expérience de Lavoisier.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
