Physique-Chimie 2de
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Identification des espèces chimiques
Ch. 2
Composition des solutions aqueuses
Ch. 3
Dénombrer les entités
Ch. 4
Le noyau de l’atome
Ch. 5
Le cortège électronique
Ch. 6
Stabilité des entités chimiques
Ch. 7
Modélisation des transformations physiques
Ch. 8
Modélisation des transformations chimiques
Ch. 9
Synthèse de molécules naturelles
Ch. 10
Modélisation des transformations nucléaires
2. Mouvement et interactions
Ch. 11
Décrire un mouvement
Ch. 12
Modéliser une action sur un système
Ch. 13
Principe d’inertie
3. Ondes et signaux
Ch. 14
Émission et perception d’un son
Ch. 15
Analyse spectrale des ondes lumineuses
Ch. 16
Propagation des ondes lumineuses
Ch. 17
Signaux et capteurs
Méthode
Fiches méthode
Fiches méthode compétences
Annexes
Cours
Identification des espèces chimiques
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Corps purs et mélanges
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AEspèces chimiques
La matière est constituée d'entités chimiques (molécules, atomes, ions).
Une espèce chimique est un ensemble d'entités chimiques identiques.
Une espèce chimique est caractérisée par sa formule, son aspect physique (état physique à température ambiante, couleur, odeur, etc.) et ses propriétés physiques (température de fusion, d'ébullition, masse volumique, indice de réfraction, etc.) et ses propriétés chimiques.
Exemples d'espèces chimiques : l'eau, l'acide acétique, le cuivre, le chlorure de sodium.
Un mélange est constitué de plusieurs espèces chimiques différentes.
Une espèce chimique est un ensemble d'entités chimiques identiques.
Une espèce chimique est caractérisée par sa formule, son aspect physique (état physique à température ambiante, couleur, odeur, etc.) et ses propriétés physiques (température de fusion, d'ébullition, masse volumique, indice de réfraction, etc.) et ses propriétés chimiques.
Exemples d'espèces chimiques : l'eau, l'acide acétique, le cuivre, le chlorure de sodium.
Un mélange est constitué de plusieurs espèces chimiques différentes.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 L'acide salicylique


Une feuille de saule est constituée de molécules diverses (eau, pectine, cellulose, lignine, etc.) et d'ions (calcium, potassium, sodium, etc.).
On peut extraire l'acide salicylique des feuilles de saule pour réaliser la synthèse de l'aspirine. L'acide salicylique est une espèce chimique d'origine naturelle que l'on synthétise aussi en laboratoire.
On peut extraire l'acide salicylique des feuilles de saule pour réaliser la synthèse de l'aspirine. L'acide salicylique est une espèce chimique d'origine naturelle que l'on synthétise aussi en laboratoire.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Corps purs simples et corps purs composés
Un corps pur est constitué d'une seule espèce chimique.
On distingue deux types de corps purs : les corps purs simples et les corps purs composés.
Un corps pur simple est constitué d'un seul type d'atomes.
Exemple : l'argent \text{Ag}, le charbon \text{C}, le dioxygène \text{O}2.
Un corps pur composé est un corps pur qui est constitué de plusieurs types d'atomes. Ces atomes différents restent dans des proportions bien définies dans le corps pur considéré.
Exemples : l'eau \text{H}_{2}\text{O}, l'éthanol \text{C}_{2}\text{H}_6\text{O}, le sel ((\text{Na}+; \text{Cl}- ) : chlorure de sodium).
On distingue deux types de corps purs : les corps purs simples et les corps purs composés.
Un corps pur simple est constitué d'un seul type d'atomes.
Exemple : l'argent \text{Ag}, le charbon \text{C}, le dioxygène \text{O}2.
Un corps pur composé est un corps pur qui est constitué de plusieurs types d'atomes. Ces atomes différents restent dans des proportions bien définies dans le corps pur considéré.
Exemples : l'eau \text{H}_{2}\text{O}, l'éthanol \text{C}_{2}\text{H}_6\text{O}, le sel ((\text{Na}+; \text{Cl}- ) : chlorure de sodium).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C Mélanges homogènes et hétérogènes
Lorsque plusieurs espèces chimiques sont mélangées, elles peuvent former deux types de mélanges : un mélange homogène ou hétérogène.
Un mélange homogène est constitué d'une seule phase.
Exemple : l'acier est un mélange homogène de carbone et de fer. C'est un alliage. Le thé (doc. 2) est aussi un mélange homogène.
Des liquides sont miscibles lorsqu'ils se mélangent l'un avec l'autre pour former un mélange homogène.
Exemple : l'eau et l'éthanol sont deux liquides miscibles en toutes proportions ; ils forment un mélange homogène et il est alors impossible de distinguer l'un de l'autre dans la solution résultante.
Un mélange hétérogène est constitué de plusieurs phases (solide, liquide, gaz), c'est-à-dire plusieurs corps que l'on peut distinguer.
Exemple : l'eau et le fer en poudre forment un mélange hétérogène.
Des liquides ne sont pas miscibles lorsqu'ils forment un mélange hétérogène, constitué de plusieurs phases distinctes (doc. 3).
Un mélange homogène est constitué d'une seule phase.
Exemple : l'acier est un mélange homogène de carbone et de fer. C'est un alliage. Le thé (doc. 2) est aussi un mélange homogène.
Des liquides sont miscibles lorsqu'ils se mélangent l'un avec l'autre pour former un mélange homogène.
Exemple : l'eau et l'éthanol sont deux liquides miscibles en toutes proportions ; ils forment un mélange homogène et il est alors impossible de distinguer l'un de l'autre dans la solution résultante.
Un mélange hétérogène est constitué de plusieurs phases (solide, liquide, gaz), c'est-à-dire plusieurs corps que l'on peut distinguer.
Exemple : l'eau et le fer en poudre forment un mélange hétérogène.
Des liquides ne sont pas miscibles lorsqu'ils forment un mélange hétérogène, constitué de plusieurs phases distinctes (doc. 3).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Le thé


Le thé est un mélange homogène, constitué de très nombreuses espèces chimiques : eau, caféine, acides aminés, minéraux, etc.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Un mélange peut sembler homogène à l'œil nu et être hétérogène si on l'observe au microscope.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Un mélange hétérogène


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Propriétés physiques des espèces chimiques
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Masse volumique et densité
Une espèce chimique est caractérisée par sa masse volumique, ou par sa densité, qui dépend de son état physique.
Selon son état physique, la masse volumique d'un échantillon peut considérablement varier.
La masse volumique \rho d'un échantillon de matière est une grandeur égale au quotient de sa masse m par le volume V qu'il occupe. Elle est donc définie par la relation : \rho=\dfrac{m}{V}.
Dans cette expression, la masse s'exprime en gramme (g), le volume en centimètre cube (cm3) et la masse volumique en gramme par centimètre cube (g·cm-3).
La densité est une grandeur sans unité. La densité d'un liquide ou d'un solide est égale au quotient de la masse volumique de l'échantillon par la masse volumique de l'eau.
La densité est donc définie par la relation : \bf{d=\dfrac{\rho}{\rho_{\text { eau }}}}
Dans cette relation, les masses volumiques doivent être exprimées dans la même unité.
Selon son état physique, la masse volumique d'un échantillon peut considérablement varier.
La masse volumique \rho d'un échantillon de matière est une grandeur égale au quotient de sa masse m par le volume V qu'il occupe. Elle est donc définie par la relation : \rho=\dfrac{m}{V}.
Dans cette expression, la masse s'exprime en gramme (g), le volume en centimètre cube (cm3) et la masse volumique en gramme par centimètre cube (g·cm-3).
La densité est une grandeur sans unité. La densité d'un liquide ou d'un solide est égale au quotient de la masse volumique de l'échantillon par la masse volumique de l'eau.
La densité est donc définie par la relation : \bf{d=\dfrac{\rho}{\rho_{\text { eau }}}}
Dans cette relation, les masses volumiques doivent être exprimées dans la même unité.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Masses volumiques de quelques espèces chimiques, à \theta = 20 °C :
\rho(eau liquide) = 1,00 g·cm-3 ;
\rho(éthanol liquide) = 0,789 g·cm-3 ;
\rho(eau solide) = 0,92 g·cm-3 à \theta = 0 °C.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Température de changement d'état
Le passage de l'état solide à liquide (ou liquide à solide) se produit à la température de fusion, notée \theta_{\mathrm{f}}.
Le passage de l'état liquide à l'état gazeux (ou de gazeux à liquide) se produit à la température d'ébullition, notée \theta_{\mathrm{éb}}.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C Solubilité
La solubilité s (exprimée en g·L-1) d'une espèce chimique (solide, liquide ou gaz) correspond à la masse maximale de cette espèce que l'on peut dissoudre dans un litre de solution (généralement de l'eau).
La solubilité dépend de la température et de la nature de la solution.
La solubilité dépend de la température et de la nature de la solution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4 Densité et flottaison
La densité d'un échantillon permet de savoir s'il coule ou s'il flotte dans l'eau. Un échantillon, non miscible, dont la densité est supérieure à 1 coule dans l'eau. Un échantillon, non misible, dont la densité est inférieure à 1 flotte dans l'eau.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
L'évaporation est un phénomène qui se produit à la surface d'un échantillon (solide ou liquide), à n'importe quelle température et qu'il ne faut pas confondre avec l'ébullition, qui se produit à une température donnée, et qui concerne l'ensemble de l'échantillon.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Identification d'espèces chimiques
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Identification par les propriétés physiques
On peut identifier une espèce chimique par ses caractéristiques physiques (aspect, couleur), mais surtout par ses propriétés physiques.
➜ Retrouvez et en vidéo .
Pour identifier une espèce chimique, il faut comparer ses propriétés physiques à celles qui sont référencées (voir l'énoncé, les fiches de sécurité du NIOSH, le livre Handbook of Chemistry ou Wikipedia).
Exemple : pour déterminer expérimentalement la température d'ébullition, de fusion, la masse volumique ou la solubilité dans un solvant, on compare la valeur obtenue avec celles fournies dans les tables de référence.
➜ Retrouvez et en vidéo .
Pour identifier une espèce chimique, il faut comparer ses propriétés physiques à celles qui sont référencées (voir l'énoncé, les fiches de sécurité du NIOSH, le livre Handbook of Chemistry ou Wikipedia).
Exemple : pour déterminer expérimentalement la température d'ébullition, de fusion, la masse volumique ou la solubilité dans un solvant, on compare la valeur obtenue avec celles fournies dans les tables de référence.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Valeurs de solubilité de quelques espèces chimiques dans différents solvants :
- Acide benzoïque à 25 °C :
- Dans l'eau : s(acide benzoïque) = 2,4 g·L-1;
- L'éthanol : s(acide benzoïque) = 43 g·L-1 ;
- Sulfate de cuivre dans l'eau :
- À 25 °C : s(\text{Cu}\text{SO}_4) = 317 g·L‑1 ;
- À 100 °C : s(\text{Cu}\text{SO}_4) = 2 033 g·L‑1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Identification par des tests chimiques
Il existe des tests chimiques qui permettent de reconnaître la présence de certaines espèces chimiques.
Pour identifier une espèce chimique, on peut réaliser des tests chimiques.
Exemples de tests chimiques :

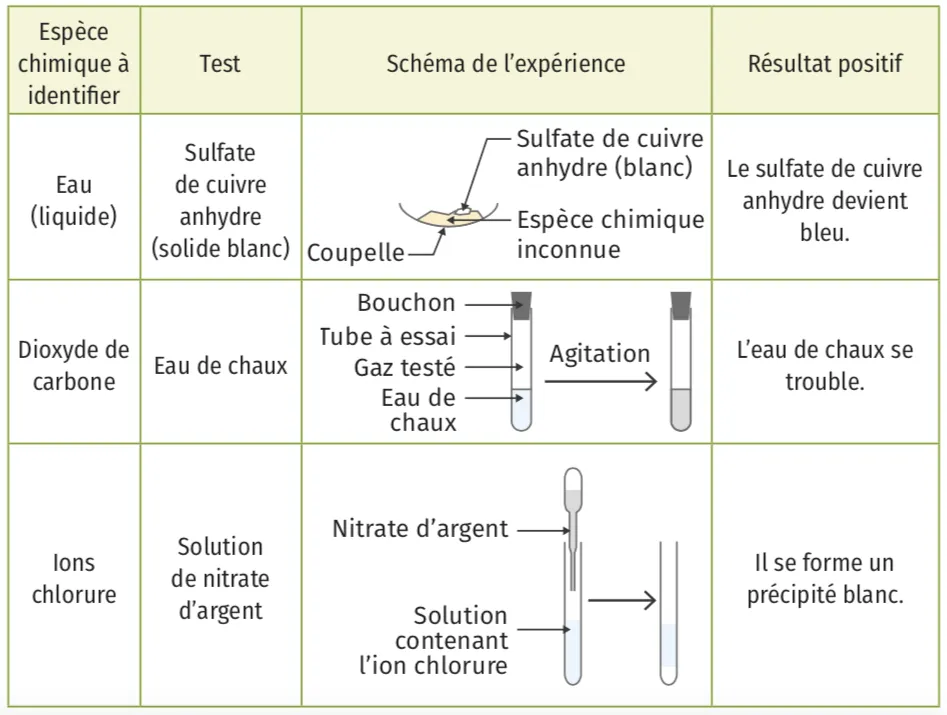
➜ Retrouvez tout les .
Pour identifier une espèce chimique, on peut réaliser des tests chimiques.
Exemples de tests chimiques :


➜ Retrouvez tout les .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5 Une poudre inconnue
Impossible d'identifier cette poudre blanche en la regardant : il faut effectuer des tests, et déterminer ses propriétés physiques pour l'identifier.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Un test chimique permet de savoir si une espèce chimique est présente dans un mélange, mais le test peut parfois être négatif alors que l'espèce est présente en trop petite quantité (donc indétectable).
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
