Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Chapitre 6
Activité 5 - Activité d'exploration
Réducteurs et oxydants
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objectif : Citer des oxydants et réducteurs usuels.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Les réactions d'oxydoréduction sont des réactions au cours desquelles se
produit un transfert d'électrons entre un réducteur, qui les cède, et un oxydant, qui les capte. Leur présence se retrouve dans de très nombreux domaines, de la biologie à la métallurgie.
Quel caractère, oxydant ou réducteur, possède les espèces chimiques autour de nous ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Dioxygène
Présent dans l'air à hauteur de 21 %, le dioxygène
\text{O}_2 est une molécule essentielle au développement de
la plupart des organismes. Son caractère oxydant est
indispensable au processus biologique de la respiration,
mais il intervient également dans les réactions de
combustion en tant que comburant.
Ce sont principalement les algues vertes et les cyanobactéries en milieu aquatique qui fournissent l'essentiel du dioxygène \text{O}_2\text{(g)} de l'atmosphère en oxydant l'eau \text{H}_2\text{O(l)} lors de la photosynthèse.
Ce sont principalement les algues vertes et les cyanobactéries en milieu aquatique qui fournissent l'essentiel du dioxygène \text{O}_2\text{(g)} de l'atmosphère en oxydant l'eau \text{H}_2\text{O(l)} lors de la photosynthèse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Dichlore


Utilisé au début de la Première Guerre mondiale
comme arme chimique, le dichlore \text{Cl}_2\text{(g)} est un gaz
toxique jaune‑vert qui a été produit à grande échelle
lors du conflit.
Sa toxicité provient de son puissant caractère oxydant.
Sa toxicité provient de son puissant caractère oxydant.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Acide ascorbique

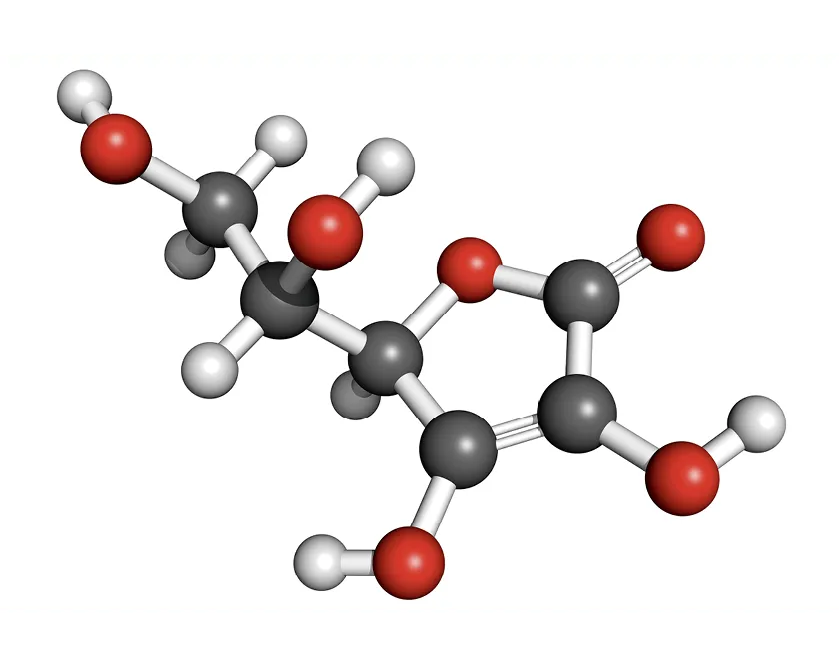
L'acide ascorbique, plus connu sous le nom de
vitamine C, est une molécule possédant des propriétés
antioxydantes que l'on retrouve dans les fruits et les
légumes frais.
Sa forte réactivité à l'égard des espèces oxydantes le conduit à former l'acide déshydroascorbique \text{C}_6\text{H}_6\text{O}_6, lequel peut être réduit à son tour grâce à l'action d'enzymes dans l'organisme.
Sa forte réactivité à l'égard des espèces oxydantes le conduit à former l'acide déshydroascorbique \text{C}_6\text{H}_6\text{O}_6, lequel peut être réduit à son tour grâce à l'action d'enzymes dans l'organisme.
Dans l'industrie agroalimentaire, il est employé comme
conservateur dans de nombreux produits comme le vin
et la bière.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4Dihydrogène


Le dihydrogène \text{H}_2\text{(aq)} est un gaz dans les conditions
normales de température et de pression. Il s'agit de la
plus petite molécule possible, si peu massique que la
pesanteur terrestre n'est pas suffisamment intense pour
pouvoir la retenir.
Chimiquement, le dihydrogène est un réducteur
appartenant au couple \text{H}^+\text{(aq)/H}_2\text{(g)} lorsqu'il est en
solution. Son oxydation est mise à profit dans les piles
à combustible pour produire un courant électrique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5Eau de javel
En 1820, en étudiant les propriétés désinfectantes
des dérivés chlorés, le chimiste et pharmacien français
Antoine Germain Labarraque met au point la première
solution d'hypochlorite de sodium (\text{Na}^+\text{(aq)} ; \text{ClO}^-\text{(aq))} à
caractère médical. Son utilisation prend de l'ampleur au
cours du \text{XIX}^\text{e} siècle, notamment comme désinfectant,
ou dans le cadre du traitement de l'eau potable.
Les propriétés désinfectantes de l'eau de Javel sont
dues à l'ion hypochlorite \text{ClO}^-\text{(aq)}, puissant oxydant qui se réduit en ion chlorure \text{Cl}^-\text{(aq)} en présence d'un
réducteur.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 6Métaux


Les métaux sont des réducteurs qui s'oxydent souvent
en formant des cations monoatomiques. En réagissant
avec le dioxygène de l'air, ceux‑ci peuvent former des
oxydes (comme la rouille dans le cas du fer \text{Fe(s)}).
Certains métaux forment rapidement une fine couche
d'oxyde protectrice, imperméable, qui leur permet de
bloquer la progression de l'oxydation. Dans le cas de
l'aluminium \text{Al(s)}, l'oxyde le plus commun est l'oxyde
d'aluminium \text{Al}_2\text{O}_3\text{(s)}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
APP : Extraire l'information utile
APP : Maîtriser le vocabulaire du cours
RAI/ANA : Utiliser et interpréter des documents
COM : Rédiger un compte‑rendu scientifiquement rigoureux
APP : Maîtriser le vocabulaire du cours
RAI/ANA : Utiliser et interpréter des documents
COM : Rédiger un compte‑rendu scientifiquement rigoureux
1. Après avoir rappelé les définitions des termes « oxydant » et « réducteur », lister dans
un tableau tous les oxydants et réducteurs cités dans les .
2. Le dichlore \text{Cl}_2\text{(aq)} dissous en solution aqueuse se réduit en ions chlorure \text{Cl}^-\text{(aq)}. Écrire la demi‑équation d'oxydoréduction correspondante.
3. L'ion hypochlorite \text{ClO}^-\text{(aq)}, présent dans l'eau de Javel, se réduit également en ion chlorure \text{Cl}^-\text{(aq)} en milieu basique. Établir la demi‑équation associée à ce couple en milieu basique en l'équilibrant à l'aide de l'eau \text{H}_2\text{O(l)} et des ions hydroxyde \text{HO}^-\text{(aq)}.
La pile à combustible évoquée dans le est un convertisseur d'énergie qui s'appuie sur une réaction d'oxydoréduction entre le dihydrogène \text{H}_2\text{(aq)} et le dioxygène \text{O}_2\text{(aq)} lors de sa décharge.
| Oxydant | Réducteur |
|---|---|
2. Le dichlore \text{Cl}_2\text{(aq)} dissous en solution aqueuse se réduit en ions chlorure \text{Cl}^-\text{(aq)}. Écrire la demi‑équation d'oxydoréduction correspondante.
3. L'ion hypochlorite \text{ClO}^-\text{(aq)}, présent dans l'eau de Javel, se réduit également en ion chlorure \text{Cl}^-\text{(aq)} en milieu basique. Établir la demi‑équation associée à ce couple en milieu basique en l'équilibrant à l'aide de l'eau \text{H}_2\text{O(l)} et des ions hydroxyde \text{HO}^-\text{(aq)}.
La pile à combustible évoquée dans le est un convertisseur d'énergie qui s'appuie sur une réaction d'oxydoréduction entre le dihydrogène \text{H}_2\text{(aq)} et le dioxygène \text{O}_2\text{(aq)} lors de sa décharge.
4. Établir les deux demi‑équations d'oxydoréduction en identifiant dans les et les
espèces à considérer. Écrire l'équation globale de la réaction.
5. Dans le cas de l'oxydation des métaux évoquée dans le , l'aluminium métallique \text{Al(s)} se transforme en alumine \text{Al}_2\text{O}_3\text{(s)}. En déduire la demi‑équation d'oxydoréduction correspondante en milieu acide.
6. Écrire la réaction d'oxydoréduction responsable de l'oxydation de l'aluminium exposé à l'air.
7. Le dioxygène joue également un rôle dans l'oxydation des alcools présents dans les boissons alcoolisées. À l'aide d'une équation de réaction d'oxydoréduction, mettre en évidence l'intérêt de rajouter de l'acide ascorbique dans le cadre de la conservation de ces boissons.
5. Dans le cas de l'oxydation des métaux évoquée dans le , l'aluminium métallique \text{Al(s)} se transforme en alumine \text{Al}_2\text{O}_3\text{(s)}. En déduire la demi‑équation d'oxydoréduction correspondante en milieu acide.
6. Écrire la réaction d'oxydoréduction responsable de l'oxydation de l'aluminium exposé à l'air.
7. Le dioxygène joue également un rôle dans l'oxydation des alcools présents dans les boissons alcoolisées. À l'aide d'une équation de réaction d'oxydoréduction, mettre en évidence l'intérêt de rajouter de l'acide ascorbique dans le cadre de la conservation de ces boissons.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Lister quelques applications des réactions d'oxydoréduction en indiquant le rôle des espèces chimiques impliquées.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
