Physique-Chimie 3e - Cahier d'activités - 2023
Nouveau manuel de Sciences et Technologie 6e
Découvrez cet ouvrage collaboratif, conforme au nouveau programme !
Mes Pages
Thème 1 : Organisation et transformations de la matière
Ch. 1
Les espèces chimiques et l'identification
Ch. 2
Les transformations chimiques
Ch. 3
Les états de la matière
Ch. 4
Les mélanges et la solubilité
Ch. 5
L'organisation de la matière dans l'Univers
Thème : 2 Mouvements et interactions
Ch. 6
La vitesse des systèmes
Ch. 7
Les nature des mouvements
Ch. 8
La modélisation des actions
Thème 3 : Énergie, transferts et conversions
Ch. 9
Les différentes formes d’énergie et les conversions
Ch. 10
Les circuits électriques et les lois
Ch. 11
La puissance électrique et la consommation
Thème 4 : Signaux pour observer et communiquer
Ch. 12
Les signaux lumineux et sonores
Annexes
Fiches méthodes
Fiche méthode 5
Tests d'identification
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Méthodologie
Identifier un gaz
| Le dioxyde de carbone : test à l'eau de chaux | Le dihydrogène : test à la flamme | Le dioxygène : test à la flamme |
|---|---|---|
| L'eau de chaux (\mathrm{Ca}^{2+} ; \mathrm{HO}^{-}) se trouble au contact du dioxyde de carbone \mathrm{CO}_2. | En approchant une allumette enflammée d'un tube à essai contenant du dihydrogène \mathrm{H}_2, une légère détonation est perçue. Ce test est aussi appelé « test du cri du chien ». | En plongeant une allumette incandescente dans un récipient contenant du dioxygène \mathrm{O}_2, celle-ci se rallume. |
Identifier l'eau : test au sulfate de cuivre anhydre
Quand le sulfate de cuivre anhydre \mathrm{CuSO}_4 devient bleu, le test est positif : l'échantillon contient de l'eau.
| Pour un échantillon solide | Pour un échantillon liquide |
|---|---|
| Déposer un peu de sulfate de cuivre anhydre sur l'échantillon, attendre quelques secondes et observer un éventuel changement de couleur. | Verser le liquide dans un bécher, ajouter un peu de sulfate de cuivre anhydre et observer un éventuel changement de couleur. |
Identifier un ion

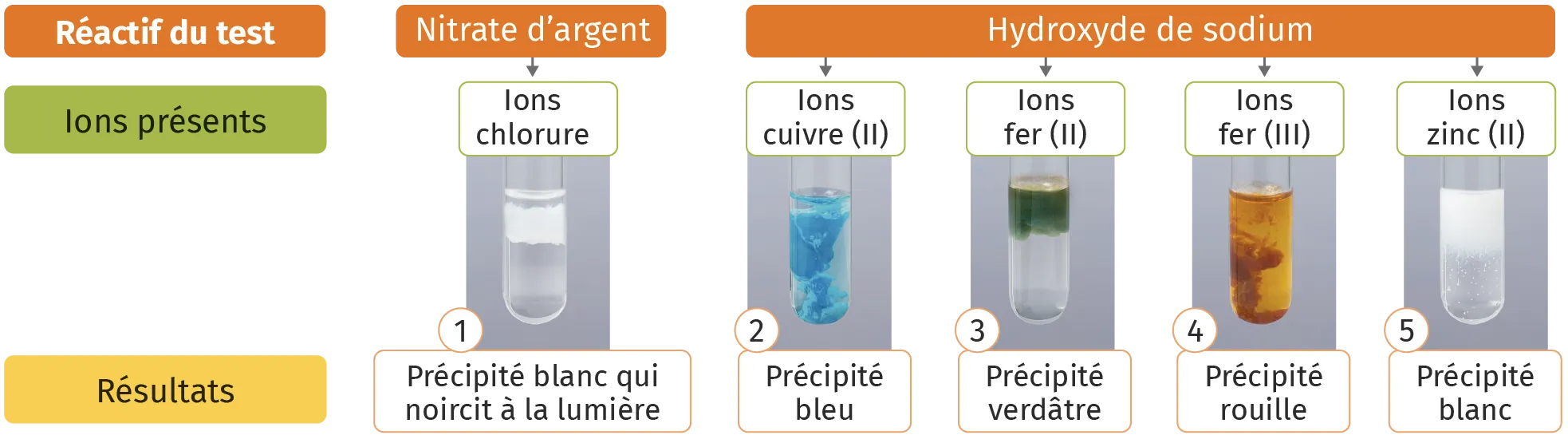
En ajoutant un réactif à une solution inconnue, un précipité peut se former. Sa couleur est caractéristique d'un ion en particulier.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Application
Pour savoir quels ions sont présents dans une solution inconnue, on y ajoute de l'hydroxyde de sodium (\mathrm{Na}^{+} ; \mathrm{HO}^{-}). Un précipité blanc se forme. En y ajoutant du nitrate d'argent, aucun précipité n'est observé.Identifier les ions présents dans cette solution.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
