Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Chapitre 4
Travailler autrement
Classe inversée
Mécanisme réactionnel
Retrouvez tous nos .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objectif : Aborder la notion de flèche courbe entre site donneur et site accepteur.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Polarisation d'une liaison
La polarité de certaines molécules ou de certaines liaisons influe sur des très nombreuses caractéristiques physicochimiques. Elle est responsable des différentes étapes conduisant une molécule à se transformer lors d'une synthèse.
Les réactions chimiques peuvent s'expliquer par des déplacements d'électrons causés en partie par des charges électriques des atomes. Une liaison covalente peut être polarisée en raison de la différence d'électronégativité des deux atomes engagés dans la liaison.
Pour accéder à l'animation
Les réactions chimiques peuvent s'expliquer par des déplacements d'électrons causés en partie par des charges électriques des atomes. Une liaison covalente peut être polarisée en raison de la différence d'électronégativité des deux atomes engagés dans la liaison.
Pour accéder à l'animation

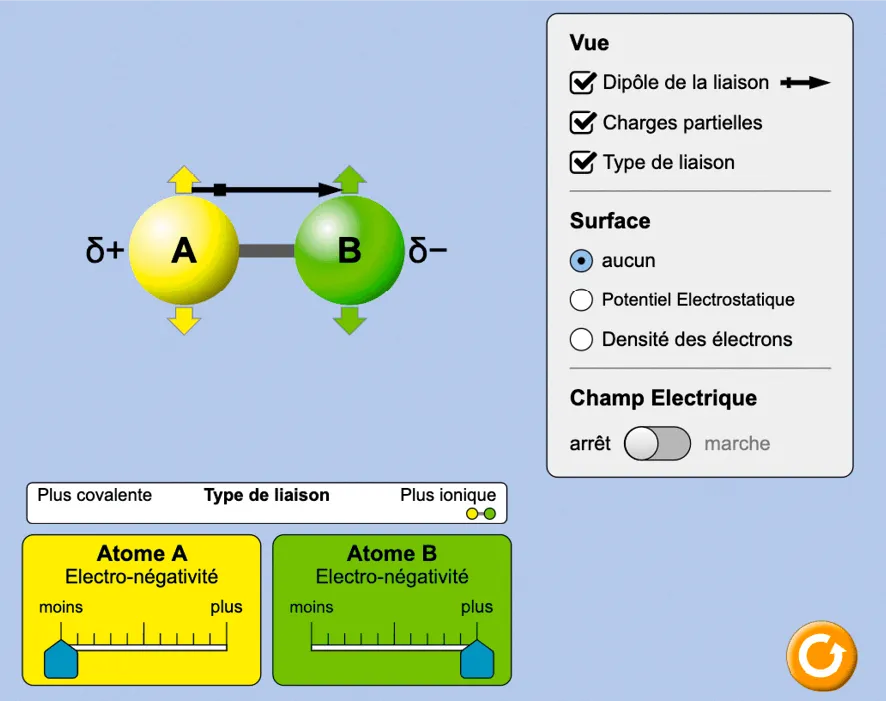
Protocole d'utilisation :
- Sélectionner le mode 2 atomes.
- Faire apparaître les charges partielles, le type de liaison et la densité d'électrons.
1. À partir des notions étudiées en classe de première, définir les termes suivants :
2. Rappeler les notations employées pour symboliser
une charge partielle.
3. Indiquer la polarisation des liaisons suivantes :
a. \text{C} \:– \:\text{O}
b. \text{C} \:– \:\text{Cl}
c. \text{O} = \text{O}
d. \text{N} \:– \:\text{H}
3. Indiquer la polarisation des liaisons suivantes :
a. \text{C} \:– \:\text{O}
b. \text{C} \:– \:\text{Cl}
c. \text{O} = \text{O}
d. \text{N} \:– \:\text{H}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B.Déplacements de doublets d'électrons
Au préalable, visionner la capsule vidéo Mécanisme réactionnel.
On étudie pour la suite la synthèse du butan‑2‑ol, dont l'équation‑bilan est la suivante :

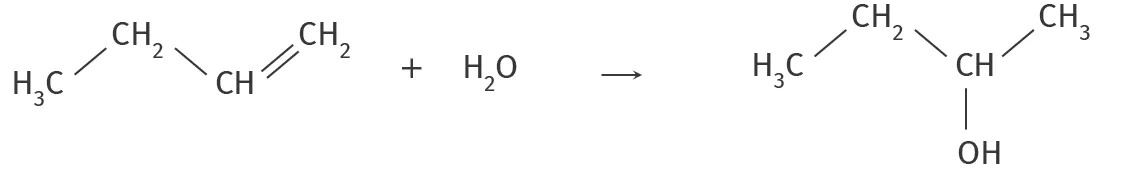
On étudie pour la suite la synthèse du butan‑2‑ol, dont l'équation‑bilan est la suivante :


Doc.
Mécanisme réactionnel

Cette réaction s'effectue en trois étapes élémentaires qui sont présentées ci-dessous.
1. Pour chaque étape, en utilisant un code couleur, identifier le site donneur et le site accepteur de doublet d'électrons. Pour cela, cliquer sur l'image et utiliser l'outil « dessin ».
2. Représenter, par des flèches, le mouvement des doublets d'électrons mis en jeu afin d'expliquer la formation ou la rupture de liaison.
3. Repérer le ou les intermédiaires réactionnels et le catalyseur.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
