Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Chapitre 4
Activité 5 - Activité d'exploration
Modélisation microscopique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objectif : Modéliser microscopiquement une transformation.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Pour comprendre l'influence des facteurs cinétiques, il faut étudier le mécanisme microscopique d'une réaction chimique.
Que se passe-t-il au niveau moléculaire ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Mécanisme réactionnel
Un mécanisme réactionnel est la succession d'étapes, appelées actes élémentaires, constituant une transformation chimique. Ce mécanisme peut faire apparaître des intermédiaires réactionnels, c'est-à-dire des espèces chimiques très instables ne participant pas à l'équation-bilan de la réaction.
Le mécanisme d'une réaction étudiée dans l'une des activités précédentes est présenté ci-dessous :
Le mécanisme d'une réaction étudiée dans l'une des activités précédentes est présenté ci-dessous :
- \text{S}_2\text{O}^{2-}_8(\text{aq})\ + \ \text{I}^-(\text{aq}) \rightarrow \ \text{S}_2\text{O}_8\text{I}^{3-}(\text{aq})
- \text{S}_2\text{O}_8\text{I}^{3-}(\text{aq}) \ + \ \text{I}^-(\text{aq}) \rightarrow \ 2\ \text{SO}^{2-}_4(\text{aq}) \ + \ \text{I}_2(\text{aq})
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Formalisme de la flèche courbe

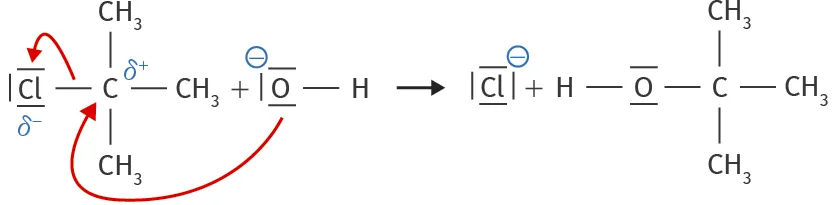
Pour représenter les interactions s'établissant à l'échelle microscopique lors des actes élémentaires, on trace des flèches courbes, orientées d'un site donneur d'électrons (un doublet d'électrons) vers un site accepteur d'électrons (un atome portant une charge partielle ou entière positive).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Mécanisme catalysé ou non
La décomposition de l'eau oxygénée se réalise classiquement en une étape lente :
2 \ \text{H}_2\text{O}_2(\text{aq}) \rightarrow \ 2 \ \text{H}_2\text{O}(\text{l}) \ + \ \text{O}_2(\text{aq})
L'ajout d'un catalyseur \text{Br}^-(\text{aq}) en milieu acide modifie le mécanisme et permet d'accélérer la réaction :
- \text{H}^+(\text{aq}) \ + \ \text{H}_2\text{O}_2(\text{aq}) \rightarrow \ \text{H}_3\text{O}^+_2 (\text{aq})
- \text{H}_3\text{O}^+_2(\text{aq}) \ + \ \text{Br}^-(\text{aq}) \rightarrow \ \text{HOBr}(\text{aq}) \ + \ \text{H}_2\text{O}(\text{l})
- \text{HOBr}(\text{aq})\ + \ \text{H}_2\text{O}_2 (\text{aq}) \rightarrow \text{H}^+(\text{aq})\ + \ \text{Br}^-(\text{aq}) \ + \ \text{O}_2(\text{aq}) \ + \ \text{H}_2 \text{O}(\text{l})
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4Cinétique en animation


Faites varier la température et la concentration des réactifs et observez les différences de comportement des entités sur .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
APP : Formuler des hypothèses
RAI/ANA : Lier modèles microscopiques et grandeurs macroscopiques
RAI/ANA : Lier modèles microscopiques et grandeurs macroscopiques
1. Retrouver l'équation de la réaction du doc. 1
à l'aide du mécanisme réactionnel fourni.
2. Proposer une définition des termes acte élémentaire et intermédiaire réactionnel. Dans le mécanisme du doc. 1 , dénombrer les actes élémentaires. Citer un intermédiaire réactionnel dans ce mécanisme.
3. Expliquer le sens des flèches courbes du doc. 2 . Proposer, pour le premier acte élémentaire du doc. 3 , une flèche courbe modélisant les déplacements d'électrons.
2. Proposer une définition des termes acte élémentaire et intermédiaire réactionnel. Dans le mécanisme du doc. 1 , dénombrer les actes élémentaires. Citer un intermédiaire réactionnel dans ce mécanisme.
3. Expliquer le sens des flèches courbes du doc. 2 . Proposer, pour le premier acte élémentaire du doc. 3 , une flèche courbe modélisant les déplacements d'électrons.
4. Retrouver l'équation de la réaction à l'aide du mécanisme réactionnel catalysé du doc. 3 .
Conclure quant à l'évolution de la quantité du catalyseur \text{Br}^-(\text{aq}) au cours de la réaction.
5. Proposer une interprétation microscopique quant à l'influence de la température et de la concentration sur la vitesse d'une réaction.
5. Proposer une interprétation microscopique quant à l'influence de la température et de la concentration sur la vitesse d'une réaction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Proposer une explication au rôle joué par le catalyseur à l'échelle microscopique.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
