Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Chapitre 4
Exercices
Objectif Bac
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
29Comprendre les attendusDécomposition de l'iodure d'hydrogène
✔ REA : Utiliser un modèle
✔ VAL : Exploiter un ensemble de mesures
À 1 000 K, et sous l'effet de la lumière, l'iodure d'hydrogène \text{HI}(\text{g}) se décompose pour former du diiode \text{I}_2(\text{g}) et du dihydrogène \text{H}_2(\text{g}). On définit dans ces conditions la concentration comme le rapport entre la quantité de matière et le volume total de gaz dans l'enceinte du milieu réactionnel. Avec une concentration initiale de 1,5 mol·L-1 en \text{HI}(\text{g}), on suit l'évolution de la concentration en diiode gazeux \text{I}_2(\text{g}) que l'on reporte dans le tableau ci-dessous.
1. Établir l'équation-bilan de la réaction.
2. Dresser le tableau d'avancement de la réaction.
✔ VAL : Exploiter un ensemble de mesures
À 1 000 K, et sous l'effet de la lumière, l'iodure d'hydrogène \text{HI}(\text{g}) se décompose pour former du diiode \text{I}_2(\text{g}) et du dihydrogène \text{H}_2(\text{g}). On définit dans ces conditions la concentration comme le rapport entre la quantité de matière et le volume total de gaz dans l'enceinte du milieu réactionnel. Avec une concentration initiale de 1,5 mol·L-1 en \text{HI}(\text{g}), on suit l'évolution de la concentration en diiode gazeux \text{I}_2(\text{g}) que l'on reporte dans le tableau ci-dessous.
| Temps t (s) | 0 | 0,50 | 1,00 | 1,50 | 2,00 | 2,50 |
| Concentration [\text{I}_2] (mol·L-1) | 0,00 | 0,24 | 0,40 | 0,51 | 0,58 | 0,64 |
1. Établir l'équation-bilan de la réaction.
2. Dresser le tableau d'avancement de la réaction.
| Avancement | \rightarrow | + | ||||
| État initial | x=0 mol | |||||
| État intermédiaire | x | |||||
| État final | x_\text{max} | |||||
3. Exprimer, puis calculer les vitesses volumiques d'apparition v du diiode à partir des concentrations fournies dans le tableau.
4. Tracer l'évolution de la vitesse volumique d'apparition du diiode v en fonction de sa concentration [\text{I}_2].
4. Tracer l'évolution de la vitesse volumique d'apparition du diiode v en fonction de sa concentration [\text{I}_2].
5. En déduire s'il s'agit d'une cinétique suivant une loi d'ordre 1. Si oui, déterminer le coefficient liant les deux grandeurs à considérer, noté k et appelé constante de vitesse.


Le diiode, à pression atmosphérique, n'existe pas à l'état liquide. Il se sublime en passant directement de l'état solide à gazeux.
Doc.
Diiode gazeux


Le diiode, à pression atmosphérique, n'existe pas à l'état liquide. Il se sublime en passant directement de l'état solide à gazeux.
Détails du barème
TOTAL / 7 pts
0,5 pt
1. Identifier le réactif et les produits.
0,5 pt
1. Ajuster l'équation.
1,5 pt
2. Remplir correctement le tableau.
1 pt
2. Exprimer les quantités de matière en fonction de l'avancement à l'aide du tableau.
1 pt
3. Exprimer la vitesse volumique d'apparition en fonction de l'écart en concentration et de la durée.
0,5 pt
3. Calculer les vitesses.
0,5 pt
4. Tracer le graphique proprement.
0,5 pt
4. Positionner correctement les points.
0,5 pt
5. Conclure sur la loi d'ordre 1.
0,5 pt
5. Déterminer la constante de vitesse.
➜ Retrouvez plus d'exercices dans
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Décomposition du peroxyde d'hydrogène
✔ RAI/MOD : Modéliser une transformation
✔ VAL : Analyser des résultats
La décomposition du peroxyde d'hydrogène \text{H}_2\text{O}_2(\text{aq}) aboutit à la formation d'eau \text{H}_2\text{O}(\text{l}) et de dioxygène \text{O}_2(\text{g}). Cette réaction est une dismutation, c'est‑à‑dire que le peroxyde d'hydrogène réagit sur lui-même pour former les deux produits mentionnés.
1. Écrire l'équation modélisant la transformation.
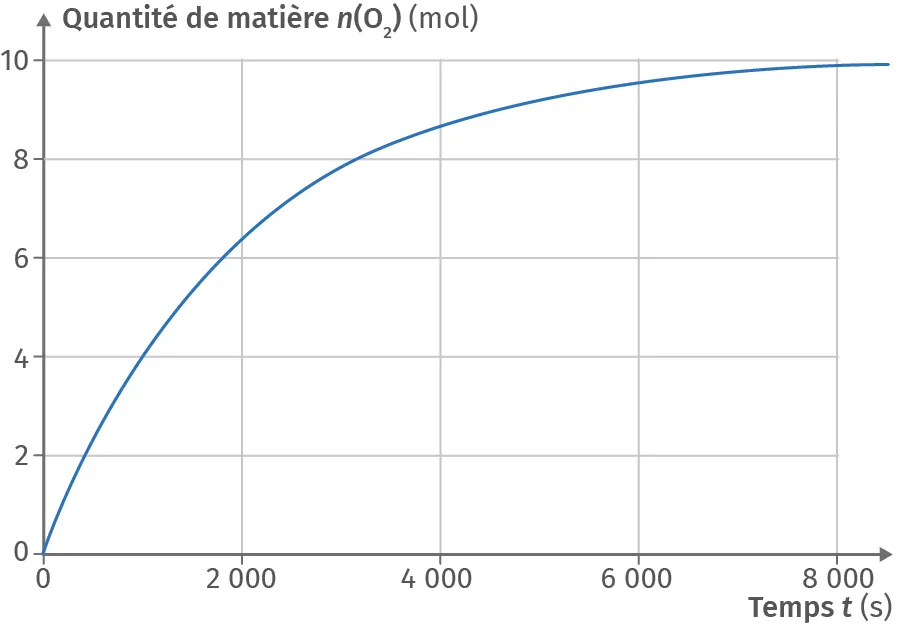
La quantité de matière initiale de peroxyde d'hydrogène est égale à n_0 (\text{H}_2\text{O}_2) = 20{,}0 mol.
2. En s'aidant éventuellement d'un tableau d'avancement, calculer l'avancement maximal.
| Avancement | \rightarrow | + | ||||
| État initial | x=0 mol | |||||
| État intermédiaire | x | |||||
| État final | x_\text{max} | |||||
3. À l'aide du graphique, déterminer le temps de demi‑réaction t_{1/2}
4. Proposer une méthode permettant d'augmenter ce temps de demi-réaction en vue d'une conservation plus longue de l'eau oxygénée, riche en peroxyde d'hydrogène.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Réduction du monoxyde d'azote
✔ REA : Utiliser un modèle
✔ RAI/MOD : Modéliser une transformation
✔ RAI/MOD : Modéliser une transformation
L'activité humaine et plus principalement les activités industrielles ont considérablement augmenté la production de monoxyde d'azote, libéré dans l'atmosphère. Cette espèce, très réactive, est l'une des espèces chimiques sur lesquelles les pouvoirs publics se sont engagés à en réduire les rejets dans l'atmosphère.
Une des voies possibles de décomposition du monoxyde d'azote est la réaction avec le dihydrogène \text{H}_2(\text{g}), selon le mécanisme :
Cette réaction se produit dans l'atmosphère en phase gazeuse. On précise que les espèces chimiques \text{N}^{\bullet}(\text{g}), \text{NO}^{\bullet}(\text{g}) et \text{H}^{\bullet}(\text{g}) sont des espèces dites radicalaires, très peu stables.
Une des voies possibles de décomposition du monoxyde d'azote est la réaction avec le dihydrogène \text{H}_2(\text{g}), selon le mécanisme :
- \text{H}_2(\text{g}) + \text{NO}^{\bullet}(\text{g}) \rightarrow \ \text{H}_2\text{O}(\text{g}) + \text{N}^{\bullet}(\text{g})
- \text{N}^{\bullet}(\text{g}) + \text{NO}^{\bullet}(\text{g}) \rightarrow \ \text{N}_2\text{O}(\text{g})
- \text{N}_2\text{O}(\text{g}) + \text{H}_2(\text{g}) \rightarrow \ \text{N}_2(\text{g}) + \text{H}_2\text{O}(\text{g})
Cette réaction se produit dans l'atmosphère en phase gazeuse. On précise que les espèces chimiques \text{N}^{\bullet}(\text{g}), \text{NO}^{\bullet}(\text{g}) et \text{H}^{\bullet}(\text{g}) sont des espèces dites radicalaires, très peu stables.
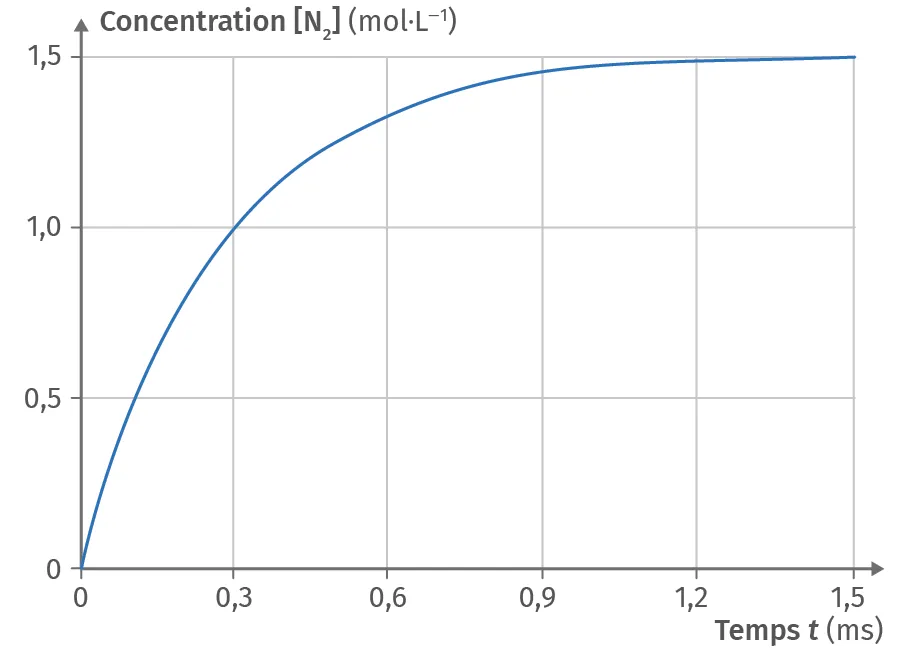
On étudie cette réaction en laboratoire avec une quantité de matière de 3,0 mol de dihydrogène dans un excès de monoxyde d'azote. La concentration du diazote, rapport entre la quantité de diazote et le volume de l'enceinte confinant le milieu réactionnel, est représentée en fonction du temps.



1. Écrire l'équation-bilan.
2. Identifier les intermédiaires réactionnels.
3. Dresser le tableau d'avancement.
| Avancement | + | \rightarrow | + | |||||
| État initial | 0 | |||||||
| État final | x_\text{max} | |||||||
4. Déterminer le temps de demi-réaction.
La constante de vitesse k est liée au temps de demi-réaction t_{1/2} selon la relation :
t_{1/2} = \dfrac{\ln(2)}{k}
t_{1/2} : temps de demi-réaction (s)
k : constante de vitesse (s-1)
t_{1/2} = \dfrac{\ln(2)}{k}
t_{1/2} : temps de demi-réaction (s)
k : constante de vitesse (s-1)
5. Calculer la constante de vitesse k.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32Décomposition du protoxyde d'azote
✔ REA : Exploiter un ensemble de mesures
✔ VAL : Analyser des résultats
✔ VAL : Analyser des résultats
Le protoxyde d'azote est utilisé comme gaz anesthésique en chirurgie. Dans la culture populaire, on emploie souvent l'expression de gaz hilarant. Sa décomposition en phase gazeuse se produit selon le mécanisme en deux étapes suivant :
Ici, les concentrations correspondent au rapport entre la quantité de gaz et le volume total de gaz du milieu réactionnel. L'expérience est réalisée avec une concentration initiale en protoxyde d'azote égale à c_0 = 5{,}0 mol·L-1. La concentration [\text{N}_2] en diazote est relevée toutes les 0,20 ms et consignée dans le tableau.
- \text{N}_2\text{O}(\text{g}) \rightarrow \ \text{N}_2(\text{g}) + \text{O}^{\bullet}(\text{g})
- \text{O}^{\bullet}(\text{g}) + \text{N}_2\text{O}(\text{g}) \rightarrow \ \text{N}_2(\text{g}) + \text{O}_2(\text{g})
Ici, les concentrations correspondent au rapport entre la quantité de gaz et le volume total de gaz du milieu réactionnel. L'expérience est réalisée avec une concentration initiale en protoxyde d'azote égale à c_0 = 5{,}0 mol·L-1. La concentration [\text{N}_2] en diazote est relevée toutes les 0,20 ms et consignée dans le tableau.


| Temps t (ms) | Concentration [\text{N}_2] en (mol·L-1) |
| 0,000 | 0,000 |
| 0,200 | 2,533 |
| 0,400 | 3,783 |
| 0,600 | 4,399 |
| 0,800 | 4,704 |
| 1,000 | 4,854 |
| 1,200 | 4,928 |
| 1,400 | 4,964 |
| 1,600 | 4,982 |
| 1,800 | 4,991 |
| 2,000 | 4,996 |
| 2,200 | 4,998 |
| 2,400 | 4,999 |
1. Identifier les intermédiaires réactionnels
apparaissant dans le mécanisme réactionnel.
2. Écrire l'équation-bilan.
3. Dresser le tableau d'avancement.
| Avancement | \rightarrow | + | ||||
| État initial | x=0 mol | |||||
| État intermédiaire | x | |||||
| État final | x_\text{max} | |||||
4. Ajouter une colonne pour calculer la concentration en protoxyde d'azote [\text{N}_2\text{O}].
5. Exprimer la vitesse volumique de disparition de \text{N}_2\text{O}(\text{g}) en fonction de sa concentration [\text{N}_2\text{O}].
6. Ajouter une colonne correspondant à la vitesse
volumique de disparition du protoxyde d'azote.
7. Tracer l'évolution de la vitesse volumique de disparition de \text{N}_2\text{O}(\text{g}) en fonction de sa concentration.
8. En déduire si la réaction est d'ordre 1.
7. Tracer l'évolution de la vitesse volumique de disparition de \text{N}_2\text{O}(\text{g}) en fonction de sa concentration.
8. En déduire si la réaction est d'ordre 1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Ions triiodure
✔ COM : Rédiger et présenter correctement une solution d'exercice
✔ VAL : Analyser des résultats
On étudie la cinétique de la réaction entre la propanone et les ions triiodure :
Pour effectuer le suivi spectrophotométrique de cette réaction, on se place à la longueur du maximum d'absorption de l'ion triiodure \text{I}_3^-(\text{aq}).
On réalise dix mesures dans un tableau :
Les conditions initiales du mélange réactionnel sont 20,0 mL de propanone, diluée dans 200,0 mL d'eau. On ajoute alors 1,0 mL de solution aqueuse de triiodure de potassium (\text{K}^+(\text{aq})\ ;\ \text{I}_3^-(\text{aq})) de concentration c_0 = 1{,}0 \times 10^{-2} mol·L-1.
De cette manière, la propanone est introduite en large excès.
✔ VAL : Analyser des résultats
D'après le sujet chimie, banque CCP, 2013
On étudie la cinétique de la réaction entre la propanone et les ions triiodure :
\text{CH}_3\text{COCH}_3(\text{aq}) + \text{I}^-_3(\text{aq}) \rightarrow \ \text{CH}_3\text{COCH}_2\text{I}(\text{aq}) + \text{H}^+(\text{aq}) + 2\ \text{I}^-(\text{aq})
Pour effectuer le suivi spectrophotométrique de cette réaction, on se place à la longueur du maximum d'absorption de l'ion triiodure \text{I}_3^-(\text{aq}).
On réalise dix mesures dans un tableau :
| Temps t (min) | Absorbance A |
| 0 | 1,89 |
| 1,0 | 1,79 |
| 2,0 | 1,68 |
| 3,0 | 1,58 |
| 4,0 | 1,48 |
| 5,0 | 1,38 |
| 6,0 | 1,28 |
| 7,0 | 1,17 |
| 8,0 | 1,07 |
| 9,0 | 0,97 |
Les conditions initiales du mélange réactionnel sont 20,0 mL de propanone, diluée dans 200,0 mL d'eau. On ajoute alors 1,0 mL de solution aqueuse de triiodure de potassium (\text{K}^+(\text{aq})\ ;\ \text{I}_3^-(\text{aq})) de concentration c_0 = 1{,}0 \times 10^{-2} mol·L-1.
De cette manière, la propanone est introduite en large excès.
1. En utilisant la loi de Beer-Lambert, exprimer la
concentration en ion triiodure [\text{I}_3^-] en fonction de l'absorbance A de la solution et d'une constante de proportionnalité, notée \kappa.
2. Représenter l'évolution de [\text{I}_3^-] en fonction du temps.
3. Calculer la vitesse volumique v de disparition des ions triiodure pour les quatre premières mesures.
2. Représenter l'évolution de [\text{I}_3^-] en fonction du temps.
3. Calculer la vitesse volumique v de disparition des ions triiodure pour les quatre premières mesures.
4. Représenter l'évolution de v en fonction de [\text{I}_3^-].
Donner un argument permettant de dire qu'il ne s'agit pas d'une réaction d'ordre 1.
On se propose de déterminer quel est l'ordre correspondant. On précise que :
5. En déduire l'ordre de la réaction.
6. Proposer une unité cohérente pour k.
Donner un argument permettant de dire qu'il ne s'agit pas d'une réaction d'ordre 1.
On se propose de déterminer quel est l'ordre correspondant. On précise que :
- pour une réaction d'ordre 0, la vitesse volumique s'écrit v = k ;
- pour une réaction d'ordre 2, la vitesse volumique s'écrit v = k \cdot [\text{I}_3^-]^2.
5. En déduire l'ordre de la réaction.
6. Proposer une unité cohérente pour k.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34Acide ascorbique
✔ VAL : Faire preuve d'esprit critique
✔ VAL : Exploiter un ensemble de mesure
On étudie la cinétique d'oxydation de la vitamine C, également appelée acide ascorbique, que l'on note pour simplification \text{AH}_2. Cette oxydation est réalisée en milieu acide par l'ion \text{Fe}(\text{CN})^{3-}_6.
Le mécanisme réactionnel est le suivant :
1. Identifier les intermédiaires réactionnels présents dans ce mécanisme réactionnel.
Dans des conditions où le \text{pH} du milieu réactionnel est maintenu constant et que les ions \text{Fe}(\text{CN})^{3-}_6 sont introduits en large excès par rapport à l'acide ascorbique, on constate que la réaction suit une loi d'ordre 1.
On réalise trois expériences différentes avec les mêmes conditions initiales en imposant une température au milieu réactionnel et en effectuant un suivi spectrophotométrique. Après calculs, on obtient, dans un tableau, les mesures pour trois températures différentes :
2. Préciser si la température est un facteur cinétique pour cette réaction. Si oui, en déduire comment évolue la vitesse de disparition de l'acide ascorbique en fonction de la température.
✔ VAL : Exploiter un ensemble de mesure
On étudie la cinétique d'oxydation de la vitamine C, également appelée acide ascorbique, que l'on note pour simplification \text{AH}_2. Cette oxydation est réalisée en milieu acide par l'ion \text{Fe}(\text{CN})^{3-}_6.
2 \ \text{Fe}(\text{CN})^{3-}_6 + \text{AH}_2(\text{aq}) \rightarrow \ 2 \ \text{Fe}(\text{CN})^{4-}_6 + \text{A}(\text{aq}) + 2\ \text{H}^+(\text{aq})
Le mécanisme réactionnel est le suivant :
- \text{AH}_2(\text{aq}) \rightarrow \ \text{HA}^-(\text{aq}) + \text{H}^+(\text{aq})
- \text{Fe}(\text{CN})^{3-}_6(\text{aq}) + \text{HA}^-(\text{aq}) \rightarrow \ \text{Fe}(\text{CN})^{4-}_6(\text{aq}) + \text{HA}(\text{aq})
- \text{HA}(\text{aq}) \rightarrow \ \text{H}^+(\text{aq}) + \text{A}^-(\text{aq})
- \text{Fe}(\text{CN})^{3-}_6(\text{aq}) + \text{A}^-(\text{aq}) \rightarrow \ \text{Fe}(\text{CN})^{4-}_6(\text{aq}) + \text{A}(\text{aq})
1. Identifier les intermédiaires réactionnels présents dans ce mécanisme réactionnel.
Dans des conditions où le \text{pH} du milieu réactionnel est maintenu constant et que les ions \text{Fe}(\text{CN})^{3-}_6 sont introduits en large excès par rapport à l'acide ascorbique, on constate que la réaction suit une loi d'ordre 1.
On réalise trois expériences différentes avec les mêmes conditions initiales en imposant une température au milieu réactionnel et en effectuant un suivi spectrophotométrique. Après calculs, on obtient, dans un tableau, les mesures pour trois températures différentes :
| Temps t (s) | Concentration [\text{AH}_2] (mol·L-1) pour T = 298 K | Concentration [\text{AH}_2] (mol·L-1) pour T = 293 K | Concentration [\text{AH}_2] (mol·L-1) pour T = 303 K |
| 0 | 0,100 0 | 0,100 0 | 0,100 0 |
| 5 | 0,090 6 | 0,092 6 | 0,089 8 |
| 10 | 0,082 1 | 0,085 7 | 0,080 6 |
| 15 | 0,074 3 | 0,079 3 | 0,072 3 |
| 20 | 0,067 3 | 0,073 5 | 0,064 9 |
| 25 | 0,061 0 | 0,068 0 | 0,058 3 |
| 30 | 0,055 3 | 0,063 0 | 0,052 3 |
| 35 | 0,050 1 | 0,058 3 | 0,047 0 |
| 40 | 0,045 4 | 0,054 0 | 0,042 2 |
| 45 | 0,041 1 | 0,050 0 | 0,037 8 |
2. Préciser si la température est un facteur cinétique pour cette réaction. Si oui, en déduire comment évolue la vitesse de disparition de l'acide ascorbique en fonction de la température.
3. À l'aide d'un tableur, calculer les vitesses volumiques de disparition de l'acide ascorbique et tracer les évolutions de cette vitesse en fonction de la concentration [\text{AH}_2].
4. En déduire les constantes de vitesse associées et
préciser comment elles évoluent en fonction de la température T.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
