Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Énoncé
La triméthylamine TMA, de formule brute \text{C}_3 \text{H}_9 \text {N}, est une molécule présente dans nos aliments. Elle possède une odeur caractéristique de poisson pourri, que l'on retrouve notamment dans l'analyse spectrale des molécules dégagées par le hareng mariné.
Elle est également associée à une maladie génétique, la triméthylaminurie, appelée aussi syndrome de l'odeur de poisson pourri. Cette maladie résulte d'un manque de production d'une enzyme, la mono‑oxygénase à flavine 3, FMO3, à l'origine de la destruction de la TMA que produit notre organisme. La TMA est alors éliminée par les sueurs, les urines ou l'haleine, ce qui provoque une odeur de poisson chez les patients souffrant de cette maladie.
Elle est également associée à une maladie génétique, la triméthylaminurie, appelée aussi syndrome de l'odeur de poisson pourri. Cette maladie résulte d'un manque de production d'une enzyme, la mono‑oxygénase à flavine 3, FMO3, à l'origine de la destruction de la TMA que produit notre organisme. La TMA est alors éliminée par les sueurs, les urines ou l'haleine, ce qui provoque une odeur de poisson chez les patients souffrant de cette maladie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Détection de la TMA chez un patient
Pour détecter la présence de cette maladie génétique,
la stratégie la plus simple consiste à déterminer
la concentration en TMA dans des échantillons
de fluides corporels d'un patient, comme l'urine.
Si la concentration en TMA est supérieure à
0{,}22 \times 10^{-9} mol⋅L-1, alors il est admis que le patient est atteint de triméthylaminurie.
À partir d'un échantillon de 50 mL d'urine d'un patient A, une solution \text{S}_1 de 10,0 mL diluée 10 fois est préparée. Un titrage par une solution d'acide chlorhydrique de concentration 0{,}080 mol⋅L-1 est réalisé.

Pour cette étude, on admettra que la TMA est la seule base susceptible de réagir et présente dans l'urine du patient.
À partir d'un échantillon de 50 mL d'urine d'un patient A, une solution \text{S}_1 de 10,0 mL diluée 10 fois est préparée. Un titrage par une solution d'acide chlorhydrique de concentration 0{,}080 mol⋅L-1 est réalisé.

Pour cette étude, on admettra que la TMA est la seule base susceptible de réagir et présente dans l'urine du patient.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Catalyse enzymatique
Dans l'organisme, la triméthylamine est transformée
en oxyde de triméthylamine suivant la réaction :
Cette réaction est catalysée par l'enzyme FMO3. L'une des causes possibles de la triméthylaminurie est une mutation de cette enzyme, ce qui entraîne son dysfonctionnement. Les scientifiques réalisent donc des études sur des enzymes mutées pour déterminer quelles mutations sont néfastes pour l'organisme.
Ci-dessous, on présente les résultats d'une étude cinétique réalisée sur l'enzyme non mutée FMO3sauvage, l'enzyme mutée sur l'acide aminé 158 FMO3158 et l'enzyme mutée sur l'acide aminé 61 FMO361.

\mathrm{C}_{3} \mathrm{H}_{9} \mathrm{N}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O}_{2}(\mathrm{aq}) \longrightarrow \mathrm{C}_{3} \mathrm{H}_{9} \mathrm{NO}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})
Cette réaction est catalysée par l'enzyme FMO3. L'une des causes possibles de la triméthylaminurie est une mutation de cette enzyme, ce qui entraîne son dysfonctionnement. Les scientifiques réalisent donc des études sur des enzymes mutées pour déterminer quelles mutations sont néfastes pour l'organisme.
Ci-dessous, on présente les résultats d'une étude cinétique réalisée sur l'enzyme non mutée FMO3sauvage, l'enzyme mutée sur l'acide aminé 158 FMO3158 et l'enzyme mutée sur l'acide aminé 61 FMO361.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
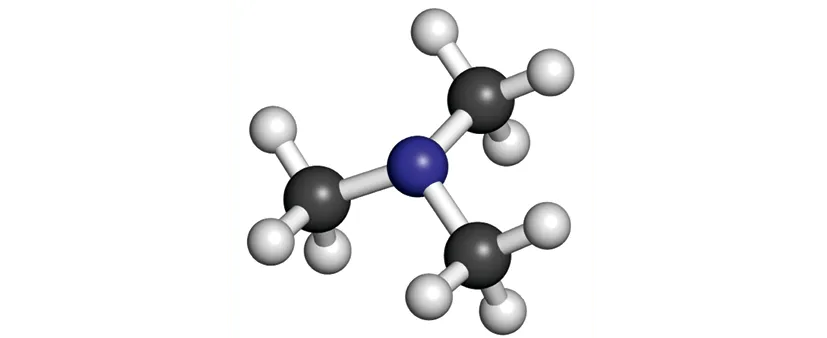
Doc. 3Modèle moléculaire de la TMA

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- \bold{p}\bm K_\bold{A} du couple \bold{C}_\bold{3} \bold{H}_\bold{9} \bold{NH}^\bold{+} \bold{(aq)/C} _\bold{3} \bold{H}_\bold{9} \bold{N} \bold{(aq)} : \text{p}K_\text{A} = 9{,}9
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
1
Détection de la TMA chez un patient
1.1. Écrire l'équation de la réaction support.
1.2. Déterminer graphiquement le volume V_\text{E} d'acide chlorhydrique versé à l'équivalence.
1.3. Définir l'équivalence. En déduire la concentration c_\text{1} de TMA présente dans la solution \text{S}_\text{1}.
1.4. En déduire la concentration c_\text{0} en TMA dans l'échantillon d'urine du patient A.
1.5. Déterminer si le patient est atteint de triméthylaminurie.
1.6. En réalité, l'urine est composée d'autres bases. Préciser si la méthode de titrage est adaptée pour mesurer la concentration en TMA dans l'échantillon d'urine. Justifier et proposer, le cas échéant, une autre méthode.
2
Étude cinétique de l'effet catalytique de la FMO3
2.1 Rappeler la définition d'un catalyseur.
2.2 Exprimer la vitesse volumique de disparition de la TMA.
2.3 Dans le cas de la FMO3sauvage, vérifier qu'il s'agit d'une réaction d'ordre 1 vis-à-vis de la TMA.
2.4 Exprimer la vitesse volumique de disparition de la TMA en fonction de sa concentration.
2.5 Préciser si la mutation de la FMO3 influence la cinétique de la réaction. Justifier la réponse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Solution rédigée
1
Détection de la TMA chez un patient
1.1. \mathrm{C}_{3} \mathrm{H}_{9} \mathrm{N}(\mathrm{aq})+\mathrm{H}_{3} \mathrm{O}^{+}(\mathrm{aq}) \rightarrow \mathrm{C}_{3} \mathrm{H}_{9} \mathrm{NH}^{+}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})
1.2 Par lecture graphique, on peut estimer que V_\text{E} = 12{,}5 mL.

1.3 À l'équivalence, les réactifs ont été introduits dans des proportions stœchiométriques. Alors :
n\left(\mathrm{H}_{3} \mathrm{O}^{+}\right)_{\text {versé }}=n\left(\mathrm{C}_{3} \mathrm{H}_{9} \mathrm{N}\right)
\left[\mathrm{H}_{3} \mathrm{O}^{+}\right] \cdot V_{\mathrm{E}}=c_{1} \cdot V_{\mathrm{A}}
c_{1}=\frac{\left[\mathrm{H}_{3} \mathrm{O}^{+}\right] \cdot V_{\mathrm{E}}}{V_{\mathrm{A}}}
\mathrm{AN}: c_{1}=\frac{0{,}080 \times 12{,}5 \times 10^{-3}}{10{,}0 \times 10^{-3}}=0,10 mol⋅L-1
1.4 L'échantillon d'urine ayant été dilué 10 fois pour obtenir la solution \text{S}_\text{1}, on a :
c_{0}=10 c_{1}
\mathrm{AN}: c_{0}=10 \times 0{,}10=1{,}0 mol⋅L-1
1.5 La concentration en TMA mesurée dans l'échantillon d'urine est très supérieure à la valeur seuil de 0{,}22 \times 10^{-9} mol\cdotL-1. Le patient A est donc atteint de triméthylaminurie.
1.6 La méthode de titrage par pH‑métrie n'est pas adaptée, car le \text{pH} mesuré dépend également des autres espèces. Il faudrait utiliser une méthode qui permette de s'intéresser spécifiquement à la TMA.
2.1 Un catalyseur est une espèce chimique qui permet d'accélérer la réaction. Il n'est ni consommé ni produit par la réaction.
2.2 La vitesse volumique de disparition de la TMA correspond à :
v_{\mathrm{TMA}}=\left|\frac{\mathrm{d}[\mathrm{TMA}]}{\mathrm{d} t}\right|
2.3 La courbe correspondant à une droite linéaire. La réaction est d'ordre 1 pour la TMA.
2.4 Pour une cinétique de réaction d'ordre 1 :
v_\text {TMA}=k_{\text {sauvage }} \cdot[\text {TMA}]
2.5 Les courbes correspondant à l'évolution de la vitesse en fonction de [TMA] pour la FMO3158 et la FMO361 sont également des droites linéaires. On peut comparer les constantes de vitesse. D'après la pente de ces droites, k_{61} \lt k_\text{sauvage} \lt k_{158}. Ainsi, la mutation de l'acide aminé 61 entraîne une diminution de l'effet catalytique de FMO3.
c_{0}=10 c_{1}
\mathrm{AN}: c_{0}=10 \times 0{,}10=1{,}0 mol⋅L-1
1.5 La concentration en TMA mesurée dans l'échantillon d'urine est très supérieure à la valeur seuil de 0{,}22 \times 10^{-9} mol\cdotL-1. Le patient A est donc atteint de triméthylaminurie.
1.6 La méthode de titrage par pH‑métrie n'est pas adaptée, car le \text{pH} mesuré dépend également des autres espèces. Il faudrait utiliser une méthode qui permette de s'intéresser spécifiquement à la TMA.
2
Étude cinétique de l'effet catalytique de la FMO3
2.1 Un catalyseur est une espèce chimique qui permet d'accélérer la réaction. Il n'est ni consommé ni produit par la réaction.
2.2 La vitesse volumique de disparition de la TMA correspond à :
v_{\mathrm{TMA}}=\left|\frac{\mathrm{d}[\mathrm{TMA}]}{\mathrm{d} t}\right|
2.3 La courbe correspondant à une droite linéaire. La réaction est d'ordre 1 pour la TMA.
2.4 Pour une cinétique de réaction d'ordre 1 :
v_\text {TMA}=k_{\text {sauvage }} \cdot[\text {TMA}]
2.5 Les courbes correspondant à l'évolution de la vitesse en fonction de [TMA] pour la FMO3158 et la FMO361 sont également des droites linéaires. On peut comparer les constantes de vitesse. D'après la pente de ces droites, k_{61} \lt k_\text{sauvage} \lt k_{158}. Ainsi, la mutation de l'acide aminé 61 entraîne une diminution de l'effet catalytique de FMO3.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
