Physique-Chimie 1re Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Composition chimique d'un système
Ch. 2
Composition chimique des solutions
Ch. 3
Évolution d'un système chimique
Ch. 4
Réactions d'oxydoréduction
Ch. 5
Détermination d'une quantité de matière par titrage
Livret Bac : Thème 1
Ch. 6
De la structure à la polarité d'une entité
Ch. 7
Interpréter les propriétés d’une espèce chimique
Ch. 8
Structure des entités organiques
Ch. 9
Synthèse d'espèces chimiques organiques
Ch. 10
Conversions d'énergie au cours d'une combustion
Livret Bac : Thème 1 bis
2. Mouvement et interactions
Ch. 11
Modélisation d'interactions fondamentales
Ch. 12
Description d'un fluide au repos
Ch. 13
Mouvement d'un système
Livret Bac : Thème 2
3. L'énergie, conversions et transferts
Ch. 14
Études énergétiques en électricité
Ch. 15
Études énergétiques en mécanique
Livret Bac : Thème 3
4. Ondes et signaux
Ch. 16
Ondes mécaniques
Ch. 17
Images et couleurs
Ch. 18
Modèles ondulatoire et particulaire de la lumière
Livret Bac : Thème 4
Méthode
Fiches méthode
Fiche méthode compétences
Annexes
Chapitre 1
Cours
Composition chimique d'un système
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1La masse molaire
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ADe quoi s'agit‑il ?
La masse molaire est la masse d'une mole d'entités chimiques (atomes, ions ou molécules) identiques. Elle est notée M et a pour unité le g·mol-1.
Chaque élément chimique naturel ou artificiel possède une masse molaire moyenne disponible dans le tableau périodique des éléments (voir doc. 1 et rabat de fin).
Cette valeur est calculée à partir de la masse et de la répartition des isotopes de cet élément.
Exemple : le chlore est présent majoritairement sous deux formes isotopiques ^{35}\text{Cl} (75{,}8\, \%) et ^{37}\text{Cl} (24{,}2 \, \%) : la masse molaire de l'élément \text{Cl} est alors de 35,5 g·mol-1. On a ainsi :
M_{\text{Cl}}=\dfrac{75{,}8}{100} \times 35+\dfrac{24{,}2}{100} \times 37=35{,}5 g·mol-1
Cette valeur est conforme à celle mentionnée dans le tableau périodique des éléments à retrouver sur le rabat de fin du manuel.
Chaque élément chimique naturel ou artificiel possède une masse molaire moyenne disponible dans le tableau périodique des éléments (voir doc. 1 et rabat de fin).
Cette valeur est calculée à partir de la masse et de la répartition des isotopes de cet élément.
Exemple : le chlore est présent majoritairement sous deux formes isotopiques ^{35}\text{Cl} (75{,}8\, \%) et ^{37}\text{Cl} (24{,}2 \, \%) : la masse molaire de l'élément \text{Cl} est alors de 35,5 g·mol-1. On a ainsi :
M_{\text{Cl}}=\dfrac{75{,}8}{100} \times 35+\dfrac{24{,}2}{100} \times 37=35{,}5 g·mol-1
Cette valeur est conforme à celle mentionnée dans le tableau périodique des éléments à retrouver sur le rabat de fin du manuel.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BComment se calcule‑t‑elle ?
La masse molaire d'une entité chimique se détermine à partir des différents éléments chimiques qui la composent.
Pour les espèces chimiques monoatomiques, la masse molaire est directement celle de l'élément telle qu'indiquée dans la classification périodique des éléments.
Pour les espèces chimiques moléculaires, la masse molaire est égale à la somme des masses molaires des éléments constituant la molécules coefficientées par le nombre d'apparition de l'élément dans la molécule.
Pour les ions, la masse molaire est la même que celle de l'espèce neutre associée, la masse des électrons gagnés ou perdus étant toujours négligeable devant la masse de l'entité chimique neutre.
Remarque : Parfois, les éléments chimiques et entités chimiques peuvent être indiqués en indice et non entre parenthèses après la lettre M.
Pour les espèces chimiques monoatomiques, la masse molaire est directement celle de l'élément telle qu'indiquée dans la classification périodique des éléments.
Pour les espèces chimiques moléculaires, la masse molaire est égale à la somme des masses molaires des éléments constituant la molécules coefficientées par le nombre d'apparition de l'élément dans la molécule.
Pour les ions, la masse molaire est la même que celle de l'espèce neutre associée, la masse des électrons gagnés ou perdus étant toujours négligeable devant la masse de l'entité chimique neutre.
- M(\text{Al})=27{,}0 g·mol-1. La masse molaire est celle indiquée dans le tableau périodique.
- La molécule de dioxyde de carbone comporte 1 atome de carbone et 2 atomes d'oxygène :
M(\text{CO}_{2})=M(\mathrm{C})+2 M(\mathrm{O})=12{,}0+2 \times 16{,}0=44{,}0 g·mol-1. - M(\mathrm{Na}^{+})=M(\mathrm{Na})=22{,}9 g·mol-1. La masse molaire d'un ion monoatomique est égale à la masse molaire de l'élément.
- M(\mathrm{SO}_{4}^{2-})=M(\mathrm{SO}_{4})=M(\mathrm{S})+4 M(\mathrm{O})=32{,}1+4 \times 16{,}0=96{,}1 g·mol -1.
Remarque : Parfois, les éléments chimiques et entités chimiques peuvent être indiqués en indice et non entre parenthèses après la lettre M.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Le chlore (\text{Cl})

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 La constante d'Avogadro
Cette constante correspond au nombre d'entités élémentaires qui se trouvent dans une mole de matière.
N_{\mathrm{A}} : 6,02 \times 1023 mol-1.
Le nom de cette constante rend hommage au chimiste Amedeo Avogadro (1776-1856) pour ses travaux quantitatifs sur les gaz. Par usage, on appelle aussi cette constante le nombre d'Avogadro.
N_{\mathrm{A}} : 6,02 \times 1023 mol-1.
Le nom de cette constante rend hommage au chimiste Amedeo Avogadro (1776-1856) pour ses travaux quantitatifs sur les gaz. Par usage, on appelle aussi cette constante le nombre d'Avogadro.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 Étiquette d'une bouteille d'éthanol
Éthanol, ou ethyl alcohol
Formule : \mathrm{C}_{2} \mathrm{H}_{6} \mathrm{O}
M= 46,07 g·mol-1
T_{\text{éb}}= 79 °C
\rho= 0,789 g·L-1
Formule : \mathrm{C}_{2} \mathrm{H}_{6} \mathrm{O}
M= 46,07 g·mol-1
T_{\text{éb}}= 79 °C
\rho= 0,789 g·L-1

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez sur le calcul des masses molaires des espèces chimiques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2La détermination d'une quantité de matière
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La quantité de matière est indispensable au chimiste pour décrire l'état d'un système chimique et expliquer son évolution. Il n'existe pas d'appareil de laboratoire permettant une mesure directe de sa valeur. Il faut donc la calculer à partir d'une autre mesure simple.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AÀ partir de la masse (tous les états)
La quantité de matière et la masse d'une même entité chimique \text{X} sont proportionnelles entre elles, suivant la relation :
n(\mathrm{X})=\dfrac{m(\mathrm{x})}{M(\mathrm{x})} avec :
n(\mathrm{X})=\dfrac{m(\mathrm{x})}{M(\mathrm{x})} avec :
- la quantité de matière n(\text{X}) en mol ;
- la masse m(\text{X}) en g ;
- la masse molaire M(\text{X}) en g·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4 Mesure expérimentale

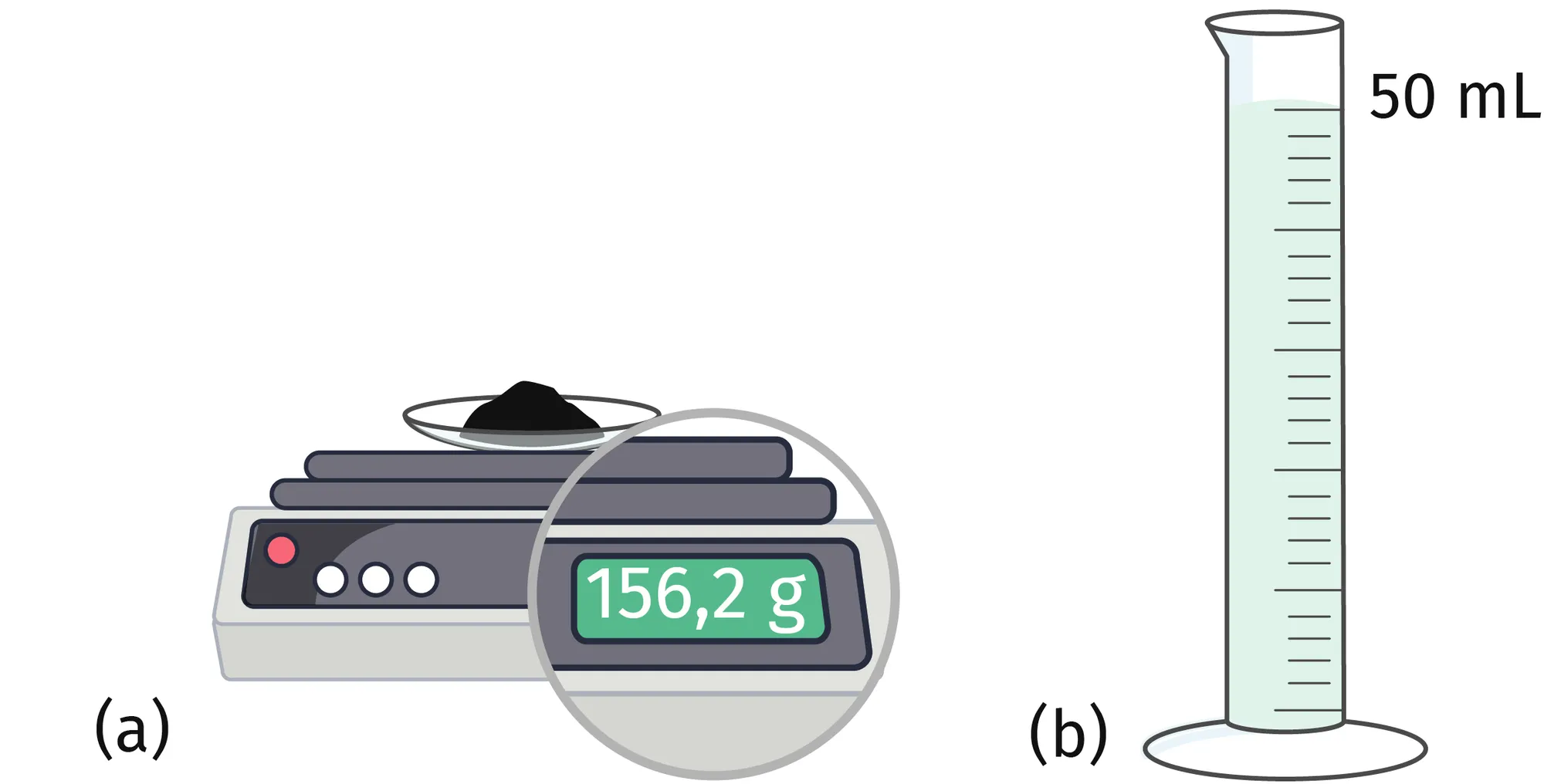
❯ 2,8 mol de fer solide (a) et 2,8 mol d'eau liquide (b).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BÀ partir du volume (corps pur liquide)
Pour les liquides, dans le cas des corps purs, il peut être plus facile de mesurer un volume. Dans ce cas, on utilise la masse volumique du liquide. La masse d'un liquide est alors le résultat du produit m(\text{X})=\rho(\text{X}) \cdot V(\text{X}).
En remplaçant dans la formule précédente, on obtient :
n(\text{X})=\rho(\text{X}) \cdot \dfrac{V(\text{X})}{M(\text{X})} avec :
En remplaçant dans la formule précédente, on obtient :
n(\text{X})=\rho(\text{X}) \cdot \dfrac{V(\text{X})}{M(\text{X})} avec :
- la quantité de matière n(\text{X}) en mol ;
- la masse volumique \rho(\text{X}) en g·L-1 ;
- le volume de corps pur liquide V(\text{X}) en L ;
- la masse molaire M(\text{X}) en g·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CÀ partir du volume (corps pur gazeux)
Dans les mêmes conditions de température et de pression, une mole de gaz occupe un volume précis qui ne dépend pas de la nature du gaz considéré. Ce même volume molaire se note V_\text{m} et s'exprime en L·mol-1. La relation est alors :
n(\text{X})=\dfrac{V(\text{X})}{V_{\text{m}}} avec :
n(\text{X})=\dfrac{V(\text{X})}{V_{\text{m}}} avec :
- la quantité de matière n(\text{X}) en mol ;
- le volume de gaz V(\text{X}) en L ;
- le volume molaire V_{\text{m}}(\text{X}) en L·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Lorsque la pression ou la température d'un système varie, alors la valeur du volume molaire varie. Par exemple, à la même pression P = 1,013 bar, le volume molaire vaut V_\text{m} = 22,4 L·mol-1 à T = 0 °C et il vaut V_\text{m} = 24,0 L·mol-1 à T = 20 °C.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Application
Corrigé
n_{\mathrm{sel}}=\dfrac{m_{\mathrm{sel}}}{M(\mathrm{NaCl})}=\dfrac{3{,}5}{58{,}5}=6{,}0 \times 10^{-2} mol ;
n_{\text {fer}}=\dfrac{m_{\text {fer}}}{M(\mathrm{Fe})}=\dfrac{4{,}2}{55{,}8}=7{,}5 \times 10^{-2} mol.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- M(\text{NaCl})= 58,5 g·mol-1;
- M(\text{Fe})= 55,8 g·mol-1.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
