Physique-Chimie 1re Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Composition chimique d'un système
Ch. 2
Composition chimique des solutions
Ch. 3
Évolution d'un système chimique
Ch. 4
Réactions d'oxydoréduction
Ch. 5
Détermination d'une quantité de matière par titrage
Livret Bac : Thème 1
Ch. 6
De la structure à la polarité d'une entité
Ch. 7
Interpréter les propriétés d’une espèce chimique
Ch. 8
Structure des entités organiques
Ch. 9
Synthèse d'espèces chimiques organiques
Ch. 10
Conversions d'énergie au cours d'une combustion
Livret Bac : Thème 1 bis
2. Mouvement et interactions
Ch. 11
Modélisation d'interactions fondamentales
Ch. 12
Description d'un fluide au repos
Ch. 13
Mouvement d'un système
Livret Bac : Thème 2
3. L'énergie, conversions et transferts
Ch. 14
Études énergétiques en électricité
Ch. 15
Études énergétiques en mécanique
Livret Bac : Thème 3
4. Ondes et signaux
Ch. 16
Ondes mécaniques
Ch. 17
Images et couleurs
Ch. 18
Modèles ondulatoire et particulaire de la lumière
Livret Bac : Thème 4
Méthode
Fiches méthode
Fiche méthode compétences
Annexes
Chapitre 7
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Solides ioniques
Quelle est la formule statistique du nitrate d'argent, du
chlorure de fer (II) et du sulfate d'aluminium ?
Données
Formule des ions : - ion nitrate \text{NO}^{-}_{3} ;
- ion argent \text{Ag}^{+} ;
- ion chlorure \text{Cl}^{-} ;
- ion fer (II) \text{Fe}^{2+} ;
- ion sulfate \text{SO}^{2-}_{4} ;
- ion aluminium \text{Al}^{3+}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AÉquation de dissolution
Écrire l'équation de dissolution du chlorure d'argent dans l'eau.
Données
Formule des ions :
- ion argent \text{Ag}^+ ;
- ion chlorure \text{Cl}^-.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Diiode
Comment la cohésion du diiode solide est-elle assurée
?Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Solubilité du sel
Le sel est un solide ionique de formule \text{NaCl}. Justifier la solubilité s = 357 g·L-1 du sel dans l'eau et sa solubilité s = 0\text{,}51 g·L-1 dans l'éthanol.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Concentration des ions
On dissout m = 3\text{,}0 g de chlorure
de sodium (\text{NaCl}) dans
V = 50 mL d'eau.Quelle est la concentration des ions dans la solution de chlorure de sodium ?
Donnée
- M(\text{NaCl}) = 58,5 g·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BCohésion du solide ionique
Quelles sont les interactions à l'origine de la cohésion de l'iodure d'argent, solide ionique constitué d'ions argent \text{Ag}^+et d'ions iodure \text{I}^-?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CCohésion d'un solide moléculaire
Quelles sont les interactions à l'origine de la cohésion de l'eau à l'état solide ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Savon


Justifier les propriétés
amphiphiles d'une
molécule de savon.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Cohésion dans un solide
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10La glace
✔ APP : Maîtriser le vocabulaire du cours
L'eau existe sous trois formes : solide, liquide, gaz. À l'état solide, les molécules d'eau sont ordonnées en cristal. Elles sont toutes en interaction les unes avec les autres et sont entourées de quatre molécules
d'eau. La figure de molécule d'eau ci-dessous représente une des configurations possibles à
l'état solide.

1.
La molécule d'eau est-elle une molécule polaire ou une
molécule apolaire ? Justifier.
2. Quels sont les types d'interactions qui peuvent exister entre les molécules d'eau au sein de la glace ?
2. Quels sont les types d'interactions qui peuvent exister entre les molécules d'eau au sein de la glace ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez sur les trois états de la
matière !
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Dissolution du solide ionique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Carbonate
✔ RAI/MOD : Modéliser une transformation chimique : écrire
l'équation
Les ions carbonate \mathrm{CO}_{3}^{2-} forment différents solides
ioniques en se combinant avec des cations.
Écrire l'équation de dissolution du carbonate de magnésium, du carbonate de calcium, du carbonate de sodium et du carbonate d'aluminium.
Écrire l'équation de dissolution du carbonate de magnésium, du carbonate de calcium, du carbonate de sodium et du carbonate d'aluminium.
Données
Formules de quelques ions :
- ion magnésium : \text{Mg}^{2+} ;
- ion calcium : \text{Ca}^{2+} ;
- ion sodium : \text{Na}^{+} ;
- ion sodium : \text{Al}^{3+}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12Équations à compléter
✔ RAI/MOD : Modéliser une transformation chimique : écrire
l'équationCompléter les équations de dissolution (dans l'eau) et donner le nom du solide ionique correspondant.
a. \text{CuSO}_{4}(
b.
c.
d. \text{Al(OH)}_{3} (
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Dissolution ou formation d'un solide
✔ RAI/MOD : Modéliser une transformation chimique : écrire
l'équationPour chacune des équations proposées, indiquer s'il s'agit d'une équation de dissolution ou de formation du précipité, et ajuster l'équation si nécessaire.
a. \text{Ag}^{+}\text{(aq)}+ \text{Cl}^{-}\text{(aq)} \rightarrow \text{AgCl(s)}.
b. \text{NaHCO}_{3}\text{(s)} \rightarrow \text{Na}^{+}\text{(aq)} + \text{HCO}^{-}_{3}\text{(aq)}.
c. \text{Al}^{3+}\text{(aq)} +\text{ SO}^{2-}_{4} \rightarrow \text{Al}_{2}(\text{SO}_{4})_{3}\text{(s)}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Concentration des ions en solution
✔ RAI/ANA : Faire le lien entre le modèle microscopique et les
grandeurs macroscopiquesOn dispose au laboratoire de plusieurs solutions aqueuses de concentration en soluté apporté c =0\text{,}50 mol·L-1, réalisées par dissolution de divers solutés.
Données
Nom et formule des solutés :
- hydroxyde de sodium \text{NaOH} ;
- sulfate de baryum \text{BaSO}_{4} ;
- chlorure de cuivre (II) \text{CuCl}_{2} ;
- nitrate d'argent \text{AgNO}_{3}.
Pour chacune des solutions :
1. Écrire l'équation de dissolution du solide ionique.
2. Calculer la concentration des ions dans les solutions.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Solvatation des ions
✔ APP : Maîtriser le vocabulaire du coursLe chlorure de cuivre (II) est très soluble dans l'eau.
Représenter schématiquement au niveau microscopique la solution aqueuse de chlorure de cuivre (II).
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Extraction par un solvant
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Choix d'un solvant
✔ RAI/ANA : Construire un raisonnement
L'acide salicylique est un solide, que l'on peut extraire par macération des feuilles de saule dans l'eau. Léo et Carla ont terminé la phase de macération et souhaitent extraire l'acide salicylique dissous.
L'acide salicylique est un solide, que l'on peut extraire par macération des feuilles de saule dans l'eau. Léo et Carla ont terminé la phase de macération et souhaitent extraire l'acide salicylique dissous.
Doc. 1
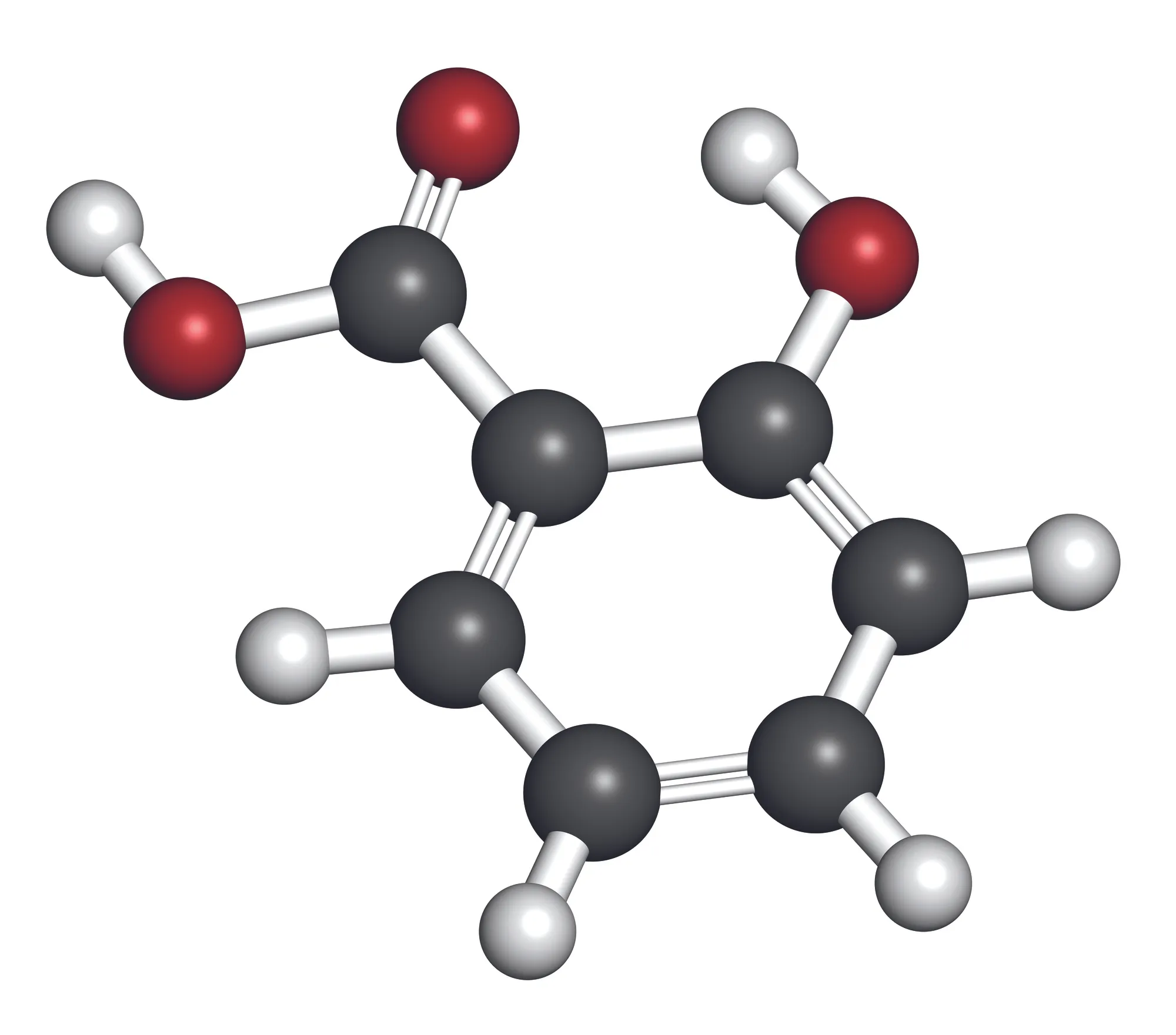
Acide salicylique

Doc. 2
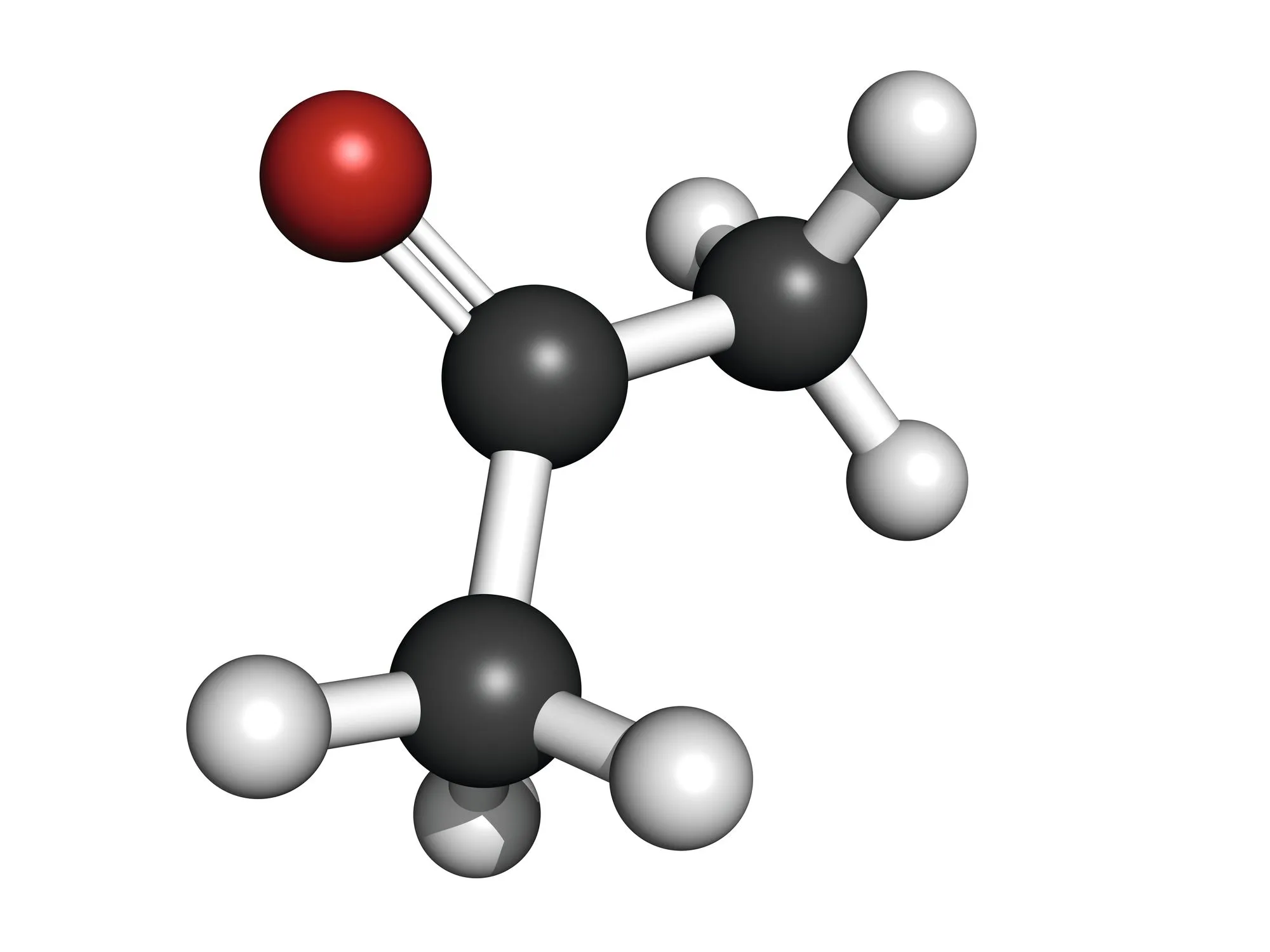
Acétone

Doc. 3
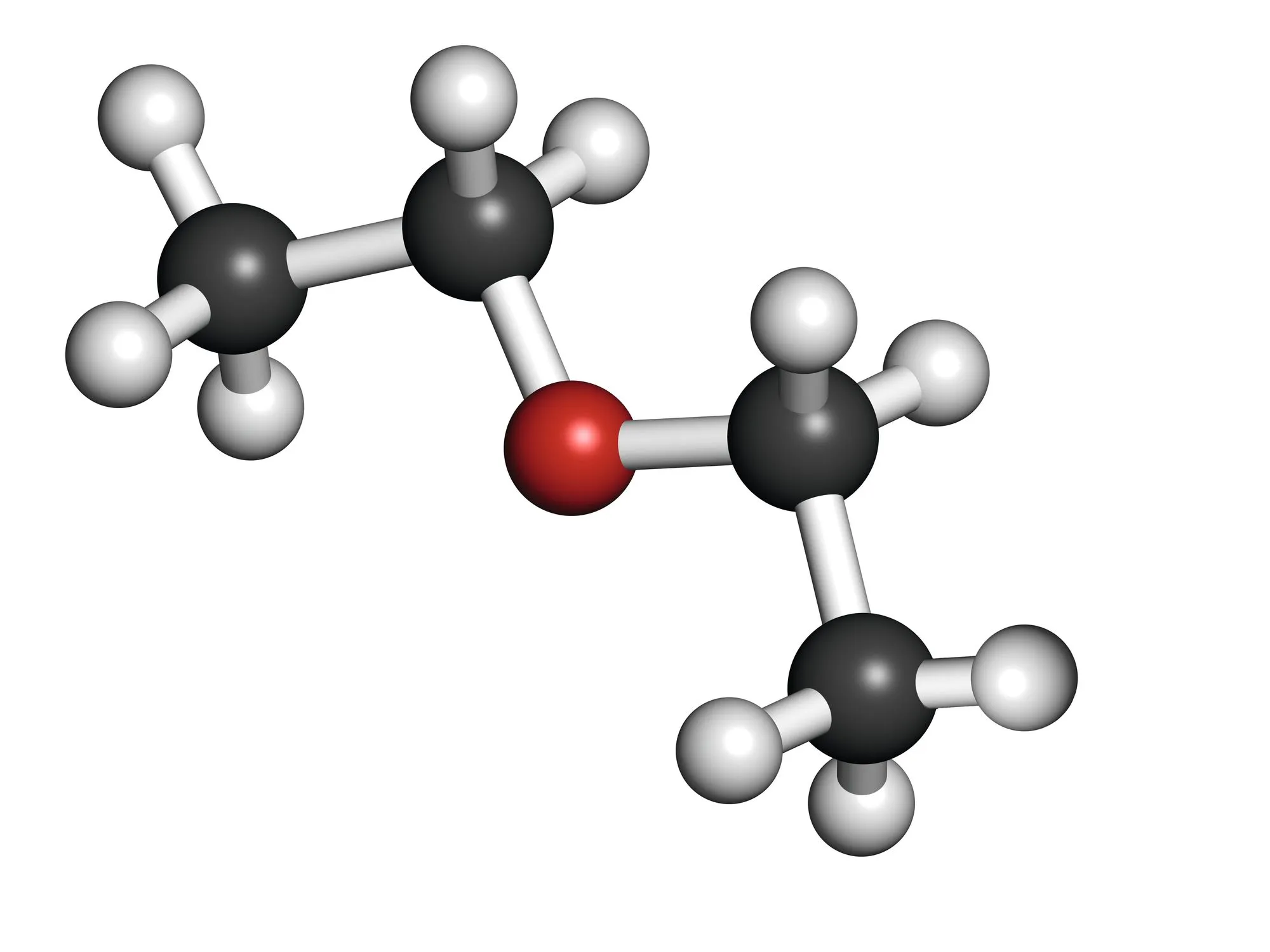
Éther

1.
Étudier la polarité des molécules d'acide salicylique,
d'acétone, d'éther et d'eau.
2. Étudier les interactions entre les molécules du soluté et des différents solvants. Ces résultats sont-ils en accord avec les données ?
3. En utilisant les données, choisir le solvant à utiliser pour extraire l'acide salicylique de la solution aqueuse.
2. Étudier les interactions entre les molécules du soluté et des différents solvants. Ces résultats sont-ils en accord avec les données ?
3. En utilisant les données, choisir le solvant à utiliser pour extraire l'acide salicylique de la solution aqueuse.
Données
| Espèce chimique | Solubilité de l'acide salicylique à 20 °C | Miscibilité avec l'eau |
| Eau | 330 mg·L-1 | / |
| Acétone | Bonne | Bonne |
| Éther | Bonne | Très faible |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Savoir-faire : Calculer la concentration des ions en solution
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- M(\text{I}) = 126\text{,}9 g·mol-1 ;
- M(\text{Al}) = 27\text{,}0 g·mol-1 ;
- M(\text{K}) = 39\text{,}1 g·mol-1 ;
- M(\text{Cl}) = 35\text{,}5 g·mol-1 ;
- M(\text{Ag}) = 107\text{,}9 g·mol-1 ;
- M(\text{S}) = 32\text{,}1 g·mol-1 ;
- M(\text{O}) = 16\text{,}0 g·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Dissolution du chlorure de potassium
✔RAI/MOD : Modéliser une transformation chimiqueOn réalise un volume V = 50\text{,}0 mL d'une solution en dissolvant une masse m = 3\text{,}0 g de chlorure de potassium.
1. Écrire l'équation de cette dissolution dans l'eau.
2. Calculer la concentration des ions dans la solution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Dissolution de l'iodure d'aluminium
✔ RAI/MOD : La quantité de matière, décrire l'état initial et l'état
finalOn dissout une masse m = 5\text{,}0 g d'iodure d'aluminium \text{AlI}_{3} pour réaliser 250\text{,}0 mL d'une solution aqueuse.
1. Écrire l'équation de cette dissolution.
2. Décrire le protocole expérimental.
3. Calculer la concentration des ions dans la solution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19Sulfate d'argent
✔ RAI/MOD : Modéliser une transformation chimiqueLa solution de sulfate d'argent est utilisée au laboratoire pour tester la présence des ions chlorure.
Elle est constituée d'ions argent \text{Ag}^{+} et d'ions sulfate \text{SO}^{2-}_{4} Le technicien de laboratoire a besoin de 500\text{,}0 mL d'une solution pour laquelle : [\text{Ag}^{+}] = 1\text{,}0 \times 10^{-2} mol·L-1.
Exprimer puis calculer la masse de soluté nécessaire pour réaliser cette solution.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
