Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Chapitre 2
Activité 3 - Activité expérimentale
120 min
Spectres de la curcumine
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objectif : Exploiter la loi de Beer-Lambert et citer son domaine de validité.
Exploiter un spectre d'absorption IR ou UV-visible.
Exploiter un spectre d'absorption IR ou UV-visible.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
La curcumine est une molécule présente dans le curcuma, une racine qui est l'ingrédient principal du curry. La curcumine est utilisée comme colorant alimentaire sous le nom E100.
Quelles informations peut-on obtenir grâce aux spectres UV-visible et infrarouge de la curcumine ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Principe de la spectroscopie UV-visible
Lorsqu'ils reçoivent un rayonnement d'énergie adéquat, les électrons d'un atome peuvent absorber ce rayonnement et changer ainsi de niveau d'énergie.
Au sein d'une molécule, les électrons participant aux liaisons, appelés électrons de valence, ont des niveaux d'énergie différents de ceux d'un atome isolé, qui dépendent de la configuration électronique de la molécule. Certaines molécules présentent une bande d'absorption pour des rayonnements situés dans le domaine du visible : elles nous apparaissent colorées.
Au sein d'une molécule, les électrons participant aux liaisons, appelés électrons de valence, ont des niveaux d'énergie différents de ceux d'un atome isolé, qui dépendent de la configuration électronique de la molécule. Certaines molécules présentent une bande d'absorption pour des rayonnements situés dans le domaine du visible : elles nous apparaissent colorées.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Principe de la spectroscopie IR
Au sein d'une molécule, les liaisons entre atomes sont susceptibles de vibrer, c'est-à-dire de s'allonger ou de se déformer légèrement, si on leur apporte l'énergie nécessaire.
C'est ce que permet le rayonnement infrarouge utilisé en spectroscopie IR. Chaque type de liaison (\text{O\;-\;H} ; \text{C\;=\; O}, etc.) vibre dans une gamme de fréquence bien particulière.
C'est ce que permet le rayonnement infrarouge utilisé en spectroscopie IR. Chaque type de liaison (\text{O\;-\;H} ; \text{C\;=\; O}, etc.) vibre dans une gamme de fréquence bien particulière.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Formule de la curcumine

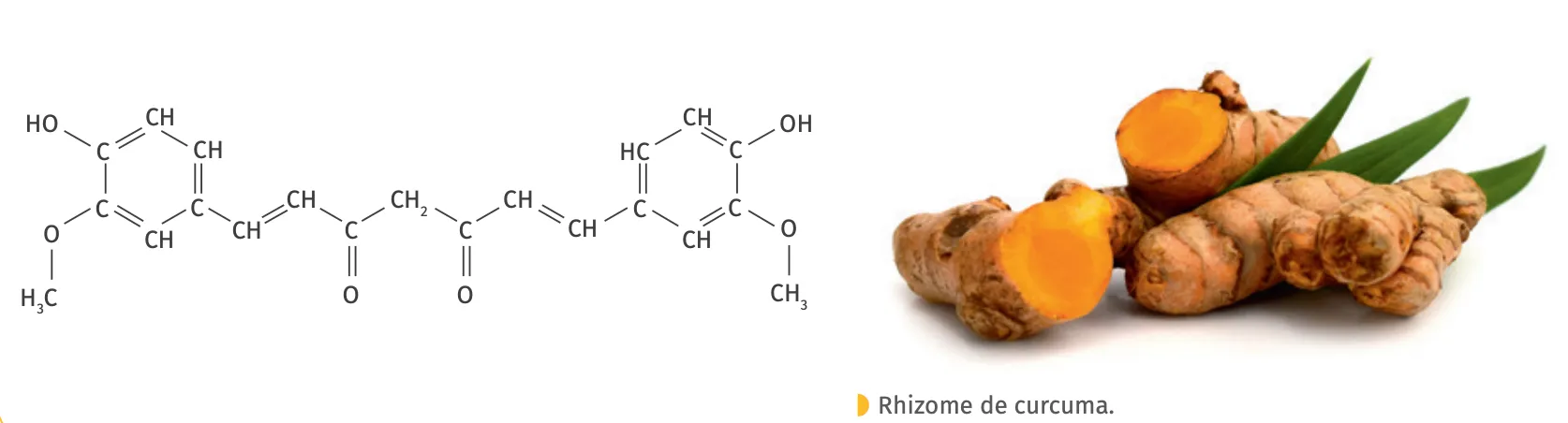
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4Spectre infrarouge de la curcumine

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5Spectre UV-visible de la curcumine

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 6Énergie d'un rayonnement
L'énergie E d'un photon associé à un rayonnement de longueur d'onde \lambda vaut :
E=\frac{h \cdot c}{\lambda}
E : énergie du photon (J)
h : constante de Planck égale à h = 6{,}63 × 10^{-34} J·s
c : vitesse de la lumière égale à c = 3{,}00 × 10^8 m·s-1
\lambda : longueur d'onde associée (m)
h : constante de Planck égale à h = 6{,}63 × 10^{-34} J·s
c : vitesse de la lumière égale à c = 3{,}00 × 10^8 m·s-1
\lambda : longueur d'onde associée (m)
On définit le nombre d'onde \bar{\nu} , autre grandeur caractéristique d'un rayonnement, selon :
\bar{\nu}=\frac{1}{\lambda}
\bar{\nu} : nombre d'onde (m-1)
\lambda : longueur d'onde (m)
\lambda : longueur d'onde (m)
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 7Protocole d'extraction de la curcumine
Pour extraire la curcumine de la poudre de curcuma, on propose le protocole suivant :
L'ajout d'acide éthanoïque pur permet de fixer la coloration de la curcumine.
- peser 0,30 g de poudre de curcuma ;
- verser la poudre dans un erlenmeyer ;
- ajouter environ 20 mL d'éthanol et agiter quelques minutes ;
- filtrer le mélange obtenu à l'aide d'un Büchner ;
- rincer le solide à l'éthanol ;
- verser le contenu de l'erlenmeyer du Büchner dans une fiole jaugée de 50,0 mL ;
- ajouter 2 mL environ d'acide éthanoïque pur ;
- remplir d'éthanol jusqu'au trait de jauge.
L'ajout d'acide éthanoïque pur permet de fixer la coloration de la curcumine.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 8Concentrations de la gamme étalon
Pour réaliser la gamme étalon, on se sert de la solution S0 de concentration en masse \gamma_0 = 10,0 mg·L-1 avec les prélèvements suivants à effectuer :
Chaque prélèvement doit être versé dans une fiole jaugée de 50,0 mL. On complétera à chaque fois avec de l'éthanol jusqu'au trait de jauge.
| Solutions | S1 | S2 | S3 | S4 |
| Volume à prélever \boldsymbol{V_0} (mL) | 10{,}0 | 20{,}0 | 30{,}0 | 40{,}0 |
Chaque prélèvement doit être versé dans une fiole jaugée de 50,0 mL. On complétera à chaque fois avec de l'éthanol jusqu'au trait de jauge.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 9Matériel nécessaire
- Spectrophotomètre
- Filtre Büchner
- Quelques papiers filtres
- Flacon d'éthanol
- Flacon d'acide éthanoïque
- Fiole jaugée de 50{,}0 mL
- Erlenmeyer de 100 mL
- Solution étalon S0 de curcumine à 10{,}0 mg·L-1 dissoute dans l'éthanol
- Solution pour le blanc
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
RAI/ANA : Lier modèles microscopiques et grandeurs macroscopiques
REA : Mettre en œuvre un protocole
REA : Effectuer des mesures avec des capteurs
REA : Mettre en œuvre un protocole
REA : Effectuer des mesures avec des capteurs
1. Identifier la spectroscopie qui utilise le rayonnement de plus grande énergie.
2. À l'aide des et , proposer une explication à la présence de bandes sur le spectre d'absorption de la curcumine.
3. Justifier la couleur de la curcumine à partir du spectre UV-visible et du cercle chromatique.
➔ Cercle chromatique en rabat de fin
4. En utilisant l'outil de dessin, entourer et nommer les groupes caractéristiques présents dans la molécule de curcumine. Retrouver et indiquer les bandes caractéristiques sur le spectre IR.
➔ Fiche méthode 16, p. 590
II. Spectrophotométrie
1. D'après le spectre d'absorption UV-visible de la curcumine, proposer une longueur d'onde de travail pour calibrer le spectrophotomètre.
2. Réaliser la série de solutions S1 à S4 et calculer leur concentration en masse.
3. Mesurer l'absorbance des solutions S0 à S4 et tracer la courbe d'étalonnage.
4. Mesurer l'absorbance de la solution de curcumine obtenue après extraction. En déduire la concentration et le pourcentage massique de curcumine dans le curcuma.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Proposer un protocole permettant de déterminer, à l'aide d'un spectrophotomètre et d'une gamme de solutions étalons, la concentration d'une boisson colorée à la curcumine.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
