Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Chapitre 2
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Conductance et résistance
Déterminer la résistance d'une portion de solution dont la conductance vaut G = 280 mS.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Mesure de conductance
Schématiser le montage expérimental permettant la mesure de la conductance d'une solution sans utiliser un conductimètre.
Cliquez pour accéder à une zone de dessin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Dilution
Décrire le protocole permettant d'obtenir 50{,}0 mL d'une solution fille à partir d'une solution mère que l'on dilue au vingtième.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Loi de Kohlrausch
Rappeler la loi de Kohlrausch en précisant les unités utilisées.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Loi de Beer-Lambert
Rappeler la loi de Beer-Lambert en précisant les unités.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Nombre d'onde
Sur un spectre infrarouge, rappeler à quoi correspond le nombre d'onde \bar{\nu}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Absorption de lumière
Déterminer la couleur de la solution dont le spectre est présenté ci-dessous.
en rabat de fin.
en rabat de fin.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Conductance et conductivité
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12Lien entre conductance et conductivité
✔ REA : Appliquer une formule
On mesure la conductance d'une solution ionique entre deux plaques, dont la surface est S = 2{,}0 cm2, distantes de l = 5{,}0 mm. On obtient G = 3{,}41 mS.
1. Exprimer la conductivité σ de la solution en fonction de G, S, l.
2. Calculer cette conductivité.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Mesure de la conductance d'une solution
✔ REA : Appliquer une formule
Entre deux plaques métalliques plongées dans une solution, on mesure U = 2{,}00 V et I = 56 mA.
Déterminer la conductance G de cette portion de solution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Cellule de conductimétrie
✔ APP : Extraire l'information utile
On plonge une cellule de conductimétrie dans une solution pour mesurer sa conductivité \sigma. Les caractéristiques de la cellule de mesure du conductimètre sont présentées dans les données ci‑dessous.
Déterminer la valeur de la conductivité affichée par le conductimètre lors de la mesure.
Déterminer la valeur de la conductivité affichée par le conductimètre lors de la mesure.
Données
- Surface de la cellule de mesure : S = 0{,}16 cm2
- Distance entre les plaques : l = 0{,}40 cm
- Résolution de l'appareil : arrondi au millième pour 2 mS·cm-1 et au centième pour 20 mS·cm-1
- Tension mesurée lors de la mesure : U = 2{,}00 V
- Intensité mesurée lors de la mesure : I = 6{,}3 mA
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Loi de Kohlrausch
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Détermination d'une conductivité
✔ REA : Appliquer une formule
On dispose d'une solution S1 d'hydroxyde de sodium \text{(Na}^+\text{(aq)} ; \text{HO}^-\text{(aq)}), de concentration c_1 = 0{,}200 mol·L-1 en soluté apporté.
Calculer la conductivité \sigma de cette solution.
Données
- Conductivités molaires ioniques à 25 °C :
\lambda\left(\mathrm{Na}^{+}\right)=5{,}01 \times 10^{-3} S·m2·mol-1 et
\lambda\left(\mathrm{HO}^{-}\right)=19{,}8 \times 10^{-3} S·m2·mol-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Conversions d'unité
✔ REA : Appliquer une formule
1. Exprimer en (mol·L-1) les concentrations suivantes :
a. c_1 = 5{,}0 mol·m-3.
b. c_2 = 0{,}050 mol·m-3.
2. Exprimer en (mol·m-3) les concentrations suivantes :
a. c_3 = 5{,}0 mol·L-1.
b. c_4 = 5{,}0 mmol·L-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Dosage par étalonnage
✔ RAI/ANA : Utiliser et interpréter des documents
Pour déterminer la concentration d'une solution d'iodure de potassium (\text{K}^+ \text{(aq)} ; \text{I}^-\text{(aq)}), on procède à un dosage par étalonnage en mesurant la conductivité \sigma de plusieurs solutions d'iodure de potassium de concentration connue.
| Concentration c (mmol·L-1) | 1{,}0 | 2{,}0 | 3{,}0 | 4{,}0 | 5{,}0 | 6{,}0 |
| Conductivité \sigma (mS·cm-1) | 3{,}43 | 6{,}85 | 10{,}3 | 13{,}7 | 17{,}2 | 20{,}6 |
1.
Tracer la courbe \sigma = f(c) à l'aide d'un tableur ou sur la calculatrice.
On plonge la même cellule de mesure dans la solution à analyser. La conductivité mesurée est \sigma = 16{,}3 mS·cm-1.
2. Déterminer la concentration de la solution analysée.


2. Déterminer la concentration de la solution analysée.
Doc.
Boîte de comprimés d'iodure de potassium


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Analyse spectrale
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Colorant alimentaire
✔ VAL : Analyser des résultats
| On présente ci-dessous le spectre UV-visible d'une espèce moléculaire utilisée comme colorant alimentaire. |
  |

1. À partir du spectre fourni, déterminer de quelle couleur l'œil humain perçoit cette solution colorée.
en rabat de fin.
2. Proposer une longueur d'onde pertinente pour réaliser un dosage par étalonnage de ce colorant en précisant pourquoi.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19Spectre infrarouge
✔ APP : Extraire l'information utile
1. Nommer les molécules dont on a représenté les modèles moléculaires.
.

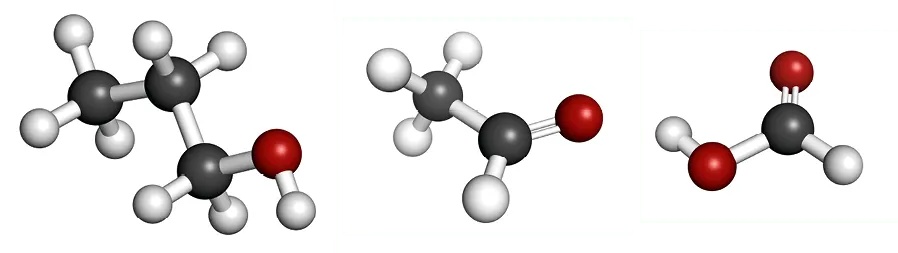
2. Le spectre infrarouge représenté ci-dessous est celui d'une de ces molécules. Préciser laquelle en analysant la présence ou non de bandes caractéristiques.
.

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Loi de Beer-Lambert
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20Permanganate de potassium
✔ RAI/ANA : Justifier un protocole
On dispose d'une solution de permanganate de potassium, de concentration approximativement égale à 2 mmol·L-1. On souhaite connaître plus précisément cette concentration. On procède pour cela à un dosage par étalonnage à la longueur d'onde \sigma = 540 nm.
1. Déterminer l'absorbance théorique de cette solution.
2. Expliquer pourquoi on ne pourra pas déterminer avec fiabilité la concentration de la solution.
2. Expliquer pourquoi on ne pourra pas déterminer avec fiabilité la concentration de la solution.
3. Proposer une solution pour pallier ce problème.
Données
- Longueur de la cuve utilisée : l = 1 cm
- Gamme de mesure du spectrophotomètre : -0,97\lt A \lt 2,5
- Coefficient d'absorption molaire du permanganate de potassium à la longueur d'onde utilisée : \varepsilon_{540 \mathrm{nm}}=2,2 \times 10^{3} L·mol-1·cm-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Diiode
✔ RAI/ANA : Utiliser et interpréter des documents
Le diiode \text{I}_2\text{(aq)} est une espèce chimique peu soluble dans l'eau. On procède au dosage par étalonnage d'une solution de diiode par spectrophotométrie.
| Concentration \boldsymbol{c} (μmol·L-1) | 50 | 250 | 750 | 1 000 |
| Absorbance A | 0{,}041 | 0{,}220 | 0{,}703 | 0{,}872 |
1. Les mesures ont été obtenues à \lambda = 470 nm, longueur d'onde pour laquelle la molécule de diiode présente une absorbance maximale. En déduire la couleur de la solution de diiode.
en rabat de fin.
2. À l'aide d'un tableur ou de la calculatrice, déterminer l'équation de la droite représentative de A = f(c), modélisant la série de données.
3. La solution de diiode analysée présente une absorbance A = 0,514. Déterminer sa concentration en quantité de matière.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22
Incertitude d'un appareil de mesure
✔ VAL : Évaluer les incertitudes
Voici ce qu'annonce le constructeur d'un conductimètre sur la notice de son appareil :
- gamme : 0-20 mS·cm-1 ;
- résolution : d = 0,01 mS·cm-1.
u(\sigma)=\frac{d}{2 \sqrt{3}}
1. Préciser la signification des deux indications fournies.
2. Calculer l'incertitude u(\sigma) sur la mesure.
3. L'appareil affiche \sigma = 2{,}73 mS·cm-1. Donner un encadrement de la conductivité mesurée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23
Incertitudes de mesure et calcul
✔ VAL : Évaluer les incertitudes
Pour déterminer la conductance G d'une portion de solution, on dispose de sa tension U et de l'intensité I du courant qui la traverse, précisées dans les données.
1. Déterminer les incertitudes u(U) et u(I) sur les valeurs de la tension et de l'intensité.
2. Calculer l'incertitude type composée qui en résulte pour la valeur de la conductance sachant que :
\frac{u(G)}{G}=\sqrt{\left(\frac{u(U)}{U}\right)^{2}+\left(\frac{u(I)}{I}\right)^{2}}
3. En déduire une valeur encadrée de la conductance G de la solution.
Données
- Tension mesurée : U = 2{,}00 \text{V}
- Intensité mesurée : I = 0{,}045 \text{A}
- Incertitude des multimètres utilisés : ± \ 0,09 %
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24
Incertitude sur une série de mesures
✔ VAL : Évaluer les incertitudes
Pour déterminer la conductivité d'une solution de manière précise, on décide de réaliser trente fois la mesure avec le même matériel, utilisé par une même personne.
| Conductivité \boldsymbol{\sigma} (mS·cm-1) | 65{,}42 | 65{,}43 | 65{,}44 | 65{,}45 |
| Nombre de mesures \boldsymbol{n} | 4 | 9 | 12 | 5 |
1. Déterminer la valeur moyenne de la conductivité.
2. À l'aide de la calculatrice ou d'un tableur, déterminer l'incertitude correspondant au rapport entre l'écarttype de la série de mesures et la racine carrée du nombre total de mesures.
3. Expliquer quel est l'intérêt de ne changer ni de matériel ni d'expérimentateur au cours de la série de mesures.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AConductivité de l'eau
✔ REA : appliquer une formule
Relation entre les concentrations dans l'eau à 25 °C : \frac{\left[\mathrm{HO}^{-}\right] \cdot\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{c^{2}}=K_{e}
Conductivités molaires ioniques à 25°C : \lambda\left(\mathrm{HO}^{-}\right)=19{,}8 mS·m2·mol-1 et \lambda\left(\mathrm{H}_{3} \mathrm{O}^{+}\right)=35{,}0 mS·m2·mol-1
Produit ionique de l'eau : K_{e}=10^{14}
- Calculer la conductivité de l'eau distillée à pH = 7,0 et à 25°C.
Données
Relation entre les concentrations dans l'eau à 25 °C : \frac{\left[\mathrm{HO}^{-}\right] \cdot\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]}{c^{2}}=K_{e}
Conductivités molaires ioniques à 25°C : \lambda\left(\mathrm{HO}^{-}\right)=19{,}8 mS·m2·mol-1 et \lambda\left(\mathrm{H}_{3} \mathrm{O}^{+}\right)=35{,}0 mS·m2·mol-1
Produit ionique de l'eau : K_{e}=10^{14}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BCoefficient d'absorption molaire
Le bleu patenté est une molécule utilisée comme colorant alimentaire, ayant une forte absorption autour de 630 nm. On mesure l'absorption à travers une cuve de largeur 1,0 cm d'une solution aqueuse de bleu patenté de concentration 5,0 × 10-6 mol·L-1 pour une longueur d'onde de 630 nm. On trouve 0,49.
1. Justifier que cette molécule est bleue.
2. Pourquoi faut‑il faire un blanc avant la mesure de l'absorbance ? Que faut‑il mettre dans la cuve pour faire le blanc ?
3. Calculer le coefficient d'absorption molaire du bleu patenté à 630 nm.
1. Justifier que cette molécule est bleue.
2. Pourquoi faut‑il faire un blanc avant la mesure de l'absorbance ? Que faut‑il mettre dans la cuve pour faire le blanc ?
3. Calculer le coefficient d'absorption molaire du bleu patenté à 630 nm.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
