Physique-Chimie 2de
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Identification des espèces chimiques
Ch. 2
Composition des solutions aqueuses
Ch. 3
Dénombrer les entités
Ch. 4
Le noyau de l’atome
Ch. 5
Le cortège électronique
Ch. 6
Stabilité des entités chimiques
Ch. 7
Modélisation des transformations physiques
Ch. 8
Modélisation des transformations chimiques
Ch. 9
Synthèse de molécules naturelles
Ch. 10
Modélisation des transformations nucléaires
2. Mouvement et interactions
Ch. 11
Décrire un mouvement
Ch. 12
Modéliser une action sur un système
Ch. 13
Principe d’inertie
3. Ondes et signaux
Ch. 14
Émission et perception d’un son
Ch. 15
Analyse spectrale des ondes lumineuses
Ch. 16
Propagation des ondes lumineuses
Ch. 17
Signaux et capteurs
Méthode
Fiches méthode
Fiches méthode compétences
Annexes
Chapitre 7
Cours
Modélisation des transformations physiques
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Modélisation des transformations physiques
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Changement d'état physique
La matière qui nous entoure peut se trouver sous trois états physiques différents : solide, liquide, gaz.
Lors d'un changement d'état physique, les propriétés de la matière changent et l'arrangement spatial des molécules est modifié.
Les différents changements d'état portent des noms distincts :

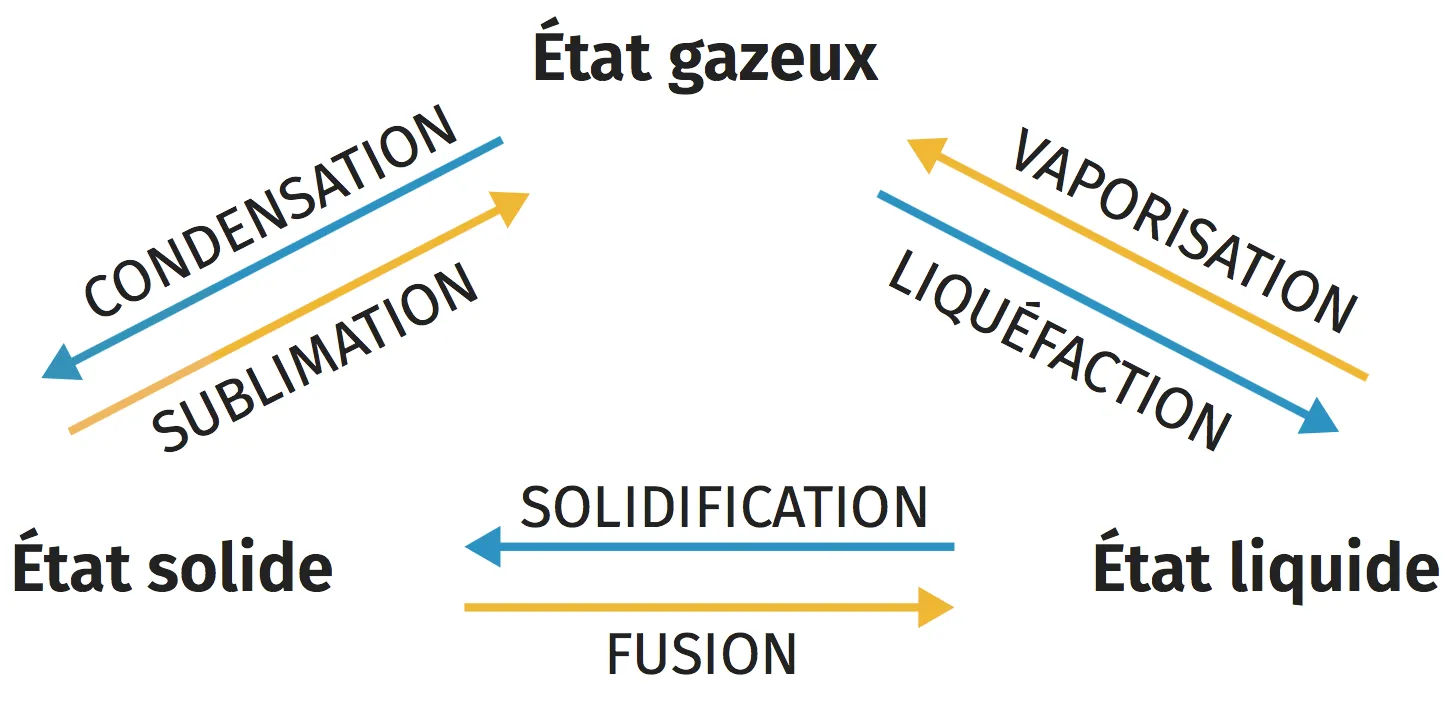
Lors d'un changement d'état physique, les propriétés de la matière changent et l'arrangement spatial des molécules est modifié.
Les différents changements d'état portent des noms distincts :


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Au cours d'une transformation
- physique : il y a changement d'état physique. Les espèces restent identiques ;
- chimique : les espèces réagissent ensemble et de nouvelles se forment.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
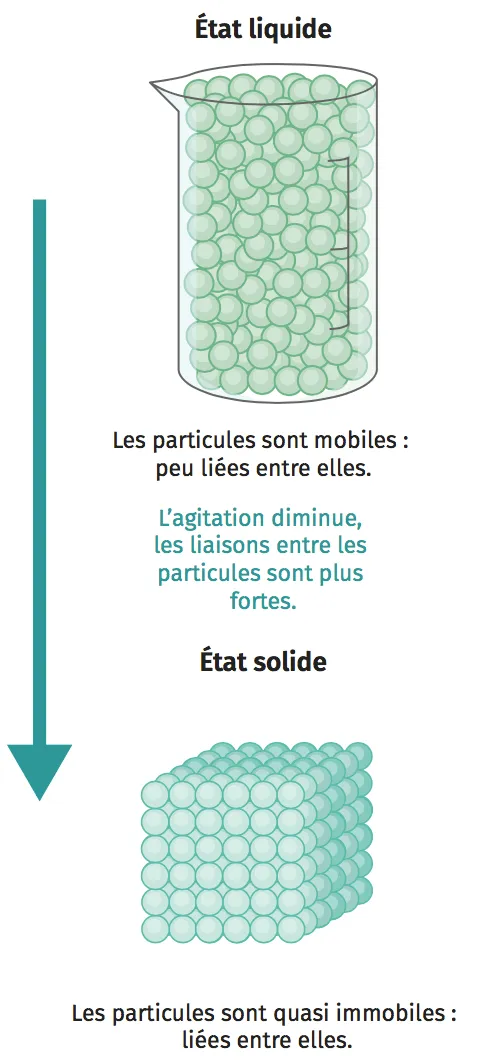
Doc. 1 Modélisation d'une solidification

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Écriture symbolique d'un changement d'état
Au cours d'un changement d'état physique, les espèces chimiques (atomes, ions, molécules) ne sont pas modifiées.
Ainsi, pour modéliser le changement d'état physique de l'espèce chimique A, on écrit :
Exemple : \text{H}_2\text{O(s)} \rightarrow \text{H}_2\text{O(l)} pour la fusion de l'eau.
Ainsi, pour modéliser le changement d'état physique de l'espèce chimique A, on écrit :
\textbf{ A (état physique 1)} \rightarrow \textbf{ A (état physique 2)}
Exemple : \text{H}_2\text{O(s)} \rightarrow \text{H}_2\text{O(l)} pour la fusion de l'eau.
Rappel
À une pression donnée, les changements d'état de corps purs s'effectuent à température constante.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les solides ont tous une forme, mais à l'échelle microscopique, on distingue :
- les cristaux (comme la glace, le sel, le diamant, la plupart des métaux, etc.) dans lesquels les espèces sont ordonnées et disposées de façon régulière ;
- les solides amorphes (comme le magma, le verre, certains polymères, etc.) dans lesquels les espèces ne possèdent pas d'ordre. Lors de la solidification, les espèces se figent de manière désordonnée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C Modélisation microscopique d'un changement d'état
Un gaz est composé d'espèces chimiques libres les unes par rapport aux autres, sans liaison entre elles. Elles se choquent sans cesse. Dans un gaz, les particules sont agitées et espacées.
Un liquide est constitué d'espèces chimiques très proches, en mouvement, reliées entre elles par des liaisons faibles. Dans un liquide, les particules sont mobiles et peu liées entre elles.
Un solide est formé d'espèces chimiques fortement liées les unes aux autres, ne disposant que de très peu de liberté de mouvement. Dans un solide, les particules sont quasi immobiles, et liées entre elles.
Au niveau microscopique, lors d'un changement d'état physique, l'agitation des espèces est modifiée jusqu'à ce que les liaisons entre les particules s'affaiblissent, se cassent ou se créent.
Exemple : lors de la solidification d'un liquide, les entités ralentissent, les liaisons entre les molécules deviennent de plus en plus fortes. Les particules sont alors quasi immobiles et liées entre elles (doc. 1).
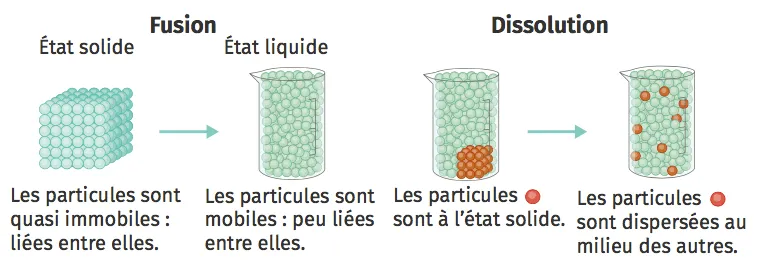
Ne pas confondre fusion et dissolution
Une fusion est un changement d'état physique : l'agitation des particules augmente, les liaisons entre elles sont plus faibles : c'est un passage d'un état compact avec une forme propre (solide) à un état compact et désordonné (liquide).
Lors d'une dissolution, les particules d'un solide sont séparées de leur voisin par un solvant. Elles se retrouvent alors dispersées dans ce nouveau milieu.

Un liquide est constitué d'espèces chimiques très proches, en mouvement, reliées entre elles par des liaisons faibles. Dans un liquide, les particules sont mobiles et peu liées entre elles.
Un solide est formé d'espèces chimiques fortement liées les unes aux autres, ne disposant que de très peu de liberté de mouvement. Dans un solide, les particules sont quasi immobiles, et liées entre elles.
Au niveau microscopique, lors d'un changement d'état physique, l'agitation des espèces est modifiée jusqu'à ce que les liaisons entre les particules s'affaiblissent, se cassent ou se créent.
Exemple : lors de la solidification d'un liquide, les entités ralentissent, les liaisons entre les molécules deviennent de plus en plus fortes. Les particules sont alors quasi immobiles et liées entre elles (doc. 1).
Ne pas confondre fusion et dissolution
Une fusion est un changement d'état physique : l'agitation des particules augmente, les liaisons entre elles sont plus faibles : c'est un passage d'un état compact avec une forme propre (solide) à un état compact et désordonné (liquide).
Lors d'une dissolution, les particules d'un solide sont séparées de leur voisin par un solvant. Elles se retrouvent alors dispersées dans ce nouveau milieu.


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Le saccharose
Équation de fusion du saccharose :
Équation de dissolution du saccharose dans un milieu aqueux (symbole (aq)) :
\text{C}_{12}\text{H}_{22}\text{O}_{11}\text{(s)} \rightarrow \text{C}_{12}\text{H}_{22}\text{O}_{11}\text{(l)}
Équation de dissolution du saccharose dans un milieu aqueux (symbole (aq)) :
\text{C}_{12}\text{H}_{22}\text{O}_{11}\text{(s)} \rightarrow \text{C}_{12}\text{H}_{22}\text{O}_{11}\text{(aq)}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Au niveau microscopique


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Les échanges d'énergie
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Transformations physiques endothermiques et exothermiques
Lors d'un chauffage, le corps capte de l'énergie au milieu extérieur. On dit que la transformation est endothermique. L'agitation des particules est plus grande, les liaisons entre les particules peuvent se rompre et le désordre augmente (doc. 3).
Les transformations physiques telles que la fusion, la vaporisation ou la sublimation absorbent de l'énergie : elles sont endothermiques.
À l'inverse, lorsque le corps perd de l'énergie, l'agitation des par- ticules diminue, les liaisons entre elles peuvent se créer et l'ordre augmente. C'est le cas lors de la solidification, de la condensation ou de la liquéfaction.
Ainsi les transformations physiques telles que la solidification, la condensation ou la liquéfaction libèrent de l'énergie vers l'extérieur : elles sont exothermiques.
Les transformations physiques telles que la fusion, la vaporisation ou la sublimation absorbent de l'énergie : elles sont endothermiques.
À l'inverse, lorsque le corps perd de l'énergie, l'agitation des par- ticules diminue, les liaisons entre elles peuvent se créer et l'ordre augmente. C'est le cas lors de la solidification, de la condensation ou de la liquéfaction.
Ainsi les transformations physiques telles que la solidification, la condensation ou la liquéfaction libèrent de l'énergie vers l'extérieur : elles sont exothermiques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BÉnergie de changement d'état
L'énergie acquise ou perdue lors d'un changement d'état (\Delta E) provient d'un transfert thermique avec un autre système. On note ce transfert thermique Q donc Q = \Delta E.
Cette quantité d'énergie est proportionnelle à la masse du corps pur qui subit la transformation.
On en déduit : Q = m \cdot L
avec Q quantité d'énergie transférée en Joule (J), m masse du corps en kilogramme (kg) et L énergie massique de changement d'état en J·kg-1. L est aussi appelée chaleur latente de changement d'état ou enthalpie de changement d'état.
Cette quantité d'énergie est proportionnelle à la masse du corps pur qui subit la transformation.
On en déduit : Q = m \cdot L
avec Q quantité d'énergie transférée en Joule (J), m masse du corps en kilogramme (kg) et L énergie massique de changement d'état en J·kg-1. L est aussi appelée chaleur latente de changement d'état ou enthalpie de changement d'état.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4Glaçon dans un verre


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
En thermodynamique, lorsque la quantité d'énergie est perdue par le corps, elle est comptée négativement. Lorsqu'elle est gagnée par le corps, elle est comptée positivement.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez ici une sur la mesure de l'énergie de vaporisation de l'eau.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
