Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Chapitre 15
Cours
Étude d'un système thermodynamique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Thermodynamique
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ANotion de système thermodynamique
La thermodynamique est la science qui traite des échanges et conversions d'énergie entre systèmes contenant un grand nombre de molécules.
Par opposition à l'échelle microscopique, l'échelle macroscopique correspond à celle du système étudié. Un système thermodynamique peut échanger de la matière avec l'extérieur.
Exemples :
Si un système thermodynamique peut échanger de la matière avec l'extérieur, il échange le plus souvent de l'énergie avec lui. Il est donc utile de définir l'énergie d'un système thermodynamique.
Un système thermodynamique est un ensemble constitué d'un nombre élevé de particules microscopiques.
Par opposition à l'échelle microscopique, l'échelle macroscopique correspond à celle du système étudié. Un système thermodynamique peut échanger de la matière avec l'extérieur.
Exemples :
- une casserole d'eau sur le feu peut échanger des molécules d'eau avec l'air environnant : il s'agit d'un système ouvert ;
- une cocotte-minute, soupape fermée, ne peut pas échanger de matière avec l'extérieur : il s'agit d'un système fermé.
Si un système thermodynamique peut échanger de la matière avec l'extérieur, il échange le plus souvent de l'énergie avec lui. Il est donc utile de définir l'énergie d'un système thermodynamique.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BÉnergie d'un système thermodynamique
Tout système thermodynamique possède une énergie cinétique macroscopique E_\text{c,macro} ainsi qu'une énergie potentielle (ou une somme d'énergies potentielles) macroscopique E_\text{p,macro}.
Pourtant, même dans le cas où ces deux valeurs sont nulles, l'énergie du système thermodynamique n'est pas nulle en raison de :
Exemple : une skieuse dans un télésiège possède à la fois une énergie interne et des énergies cinétique et potentielle macroscopiques (déplacement du télésiège).
- l'énergie cinétique microscopique E_\text{c,micro} due à l'agitation des molécules ;
- l'énergie potentielle d'interaction E_\text{p,micro} entre les différentes molécules, dépendant de leur distance moyenne.
L'énergie interne \color{black}U d'un système thermodynamique rend compte de phénomènes ayant lieu à l'échelle microscopique (agitation des molécules et interactions attractives ou répulsives) :
\color{black}U = E_\text{c,micro} + E_\text{p,micro}
Exemple : une skieuse dans un télésiège possède à la fois une énergie interne et des énergies cinétique et potentielle macroscopiques (déplacement du télésiège).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CVariables d'état
Pour décrire un système thermodynamique, on utilise un nombre réduit de grandeurs physiques, appelées « variables d'état » du système, comme la température T, la pression p, la masse volumique \rho, etc. Ces variables d'état sont mesurables et permettent de caractériser l'état d'équilibre du système.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1 Origines


Dès la fin du XVIIe siècle, l'invention de la machine à vapeur, à l'origine de la première révolution industrielle, a ouvert la voie à la construction de machines thermiques (turbine, moteur, etc.) permettant la transformation d'énergie thermique en énergie mécanique. Ce n'est que plus tard, au XIXe siècle, que ces machines ont été décrites théoriquement dans un cadre scientifique nouveau. C'est l'avènement de la thermodynamique, avec notamment les Réflexions sur la puissance motrice du feu (1824) de Sadi Carnot.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2 Sadi Carnot (1796‑1832)


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Particule microscopique
Équilibre thermique
Particule microscopique : élément de base qui constitue la matière, qui peut être un atome, un ion ou une molécule (cas le plus fréquent).
Équilibre thermique : deux corps échangeant de l'énergie thermique sont dits en équilibre lorsque leur température s'égalise.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Modèle du gaz parfait
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ADu macroscopique au microscopique
La différence la plus frappante entre les différents états de la matière est la masse volumique \rho : pour un gaz, elle est d'environ 1 kg⋅m-3. Cela est typiquement 1 000 fois plus faible que la masse volumique d'un solide ou d'un liquide (de 103 kg⋅m-3 à 104 kg⋅m-3).
En effet, les états solide et liquide ont pour caractéristique commune de présenter des molécules très proches les unes des autres (distance de l'ordre de la taille d'une molécule). À l'inverse, dans un gaz, les molécules sont très espacées les unes des autres.
La masse volumique \color{black}\rho renseigne sur la distance entre les particules microscopiques.
En effet, les états solide et liquide ont pour caractéristique commune de présenter des molécules très proches les unes des autres (distance de l'ordre de la taille d'une molécule). À l'inverse, dans un gaz, les molécules sont très espacées les unes des autres.
En thermodynamique, on définit la température \color{black}T, exprimée en kelvin (K), comme proportionnelle à l'énergie cinétique microscopique moyenne des molécules.
La température \color{black}T reflète l'agitation à l'échelle microscopique : on parle d'agitation thermique.
La pression \color{black}p, en pascal (Pa), permet de mesurer l'intensité des chocs des molécules de gaz avec la paroi du récipient qui les contient. Elle est d'autant plus faible que le gaz est dilaté.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BÉquation d'état d'un gaz parfait
Pour étudier un système à l'état gazeux, on peut se placer dans le cadre du modèle du gaz parfait, qui assimile les molécules du gaz à des points matériels et qui suppose qu'il n'y a aucune interaction entre ces molécules. Ce modèle permet d'établir une équation reliant différentes variables d'état, appelée équation d'état du gaz parfait :
\color{black}p : pression du gaz parfait (Pa)
\color{black}V : volume du gaz parfait (m3)
\color{black}n : quantité de matière de gaz parfait (mol)
\color{black}R : constante des gaz parfaits égale à \color{black}R = 8{,}314 J⋅mol-1⋅K-1
\color{black}T : température du gaz parfait (K)
\color{black}p \cdot V = n \cdot R \cdot T
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CLimites de validité du modèle
Comme tout modèle, le gaz parfait ne permet pas de décrire avec justesse un gaz, quelles que soient les conditions.
À haute pression, on ne peut plus négliger le volume occupé par les molécules devant le volume occupé par le gaz. Par ailleurs, pour certains gaz, il existe des interactions importantes entre les molécules du gaz. Enfin, à basse température, l'énergie cinétique devient trop faible : on ne peut plus négliger l'énergie d'interaction. D'autres modèles permettent alors une description plus adaptée.
À haute pression, on ne peut plus négliger le volume occupé par les molécules devant le volume occupé par le gaz. Par ailleurs, pour certains gaz, il existe des interactions importantes entre les molécules du gaz. Enfin, à basse température, l'énergie cinétique devient trop faible : on ne peut plus négliger l'énergie d'interaction. D'autres modèles permettent alors une description plus adaptée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3 États de la matière

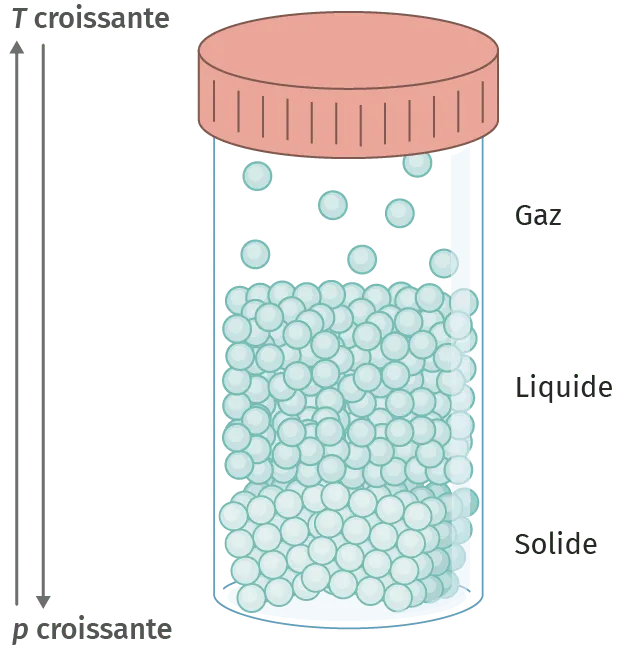
La matière existe principalement sous trois états : solide, liquide et gaz.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Il ne faut pas penser que la structure d'un solide et celle d'un liquide sont identiques. Elles diffèrent par la mobilité des molécules : à l'état solide, les molécules occupent des positions d'équilibre stables alors que dans un liquide, elles sont libres de se déplacer.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez une animation sur la loi des gaz parfaits en .
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
État gazeux
Point matériel
État gazeux : se dit de l'état dans lequel se trouve un corps qui occupe tout le volume à sa disposition.
Point matériel : en mécanique, modélisation qui permet d'assimiler un élément de matière à un point de l'espace de volume nul auquel on associe une masse (non nulle).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Premier principe
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
AÉnoncé
Pour les systèmes fermés subissant une transformation thermodynamique, on définit un principe de conservation de l'énergie, que l'on appelle « premier principe de la thermodynamique ». Celui-ci relie la variation d'énergie \Delta{E} = E_\text{final} - E_\text{initial} du système, le travail W et l'énergie échangée Q par transfert thermique par le système : \Delta{E} = W + Q
S'il n'y a ni variation d'énergie cinétique macroscopique ni variation d'énergie potentielle extérieure, le premier principe stipule que la variation d'énergie interne \color{black}\Delta{U} est égale à :
\color{black}\Delta{U} : variation d'énergie interne (J)
\color{black}W : travail (J)
\color{black}Q : énergie échangée par transfert thermique (J)
\color{black}\Delta{U} = W + Q
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BTransfert thermique
Les échanges d'énergie d'un système fermé avec l'extérieur peuvent être de plusieurs natures : transferts d'énergie électrique, mécanique, thermique, chimique, etc.
Les transferts d'énergie mécanique ont lieu sous forme de travail W. Ils n'ont lieu que si le système est déformable (ou compressible) et résultent d'une action mécanique macroscopique exercée sur le système.
Les transferts thermiques résultent de transferts d'énergie à l'échelle microscopique, de manière totalement désordonnée. Tout comme le travail W, l'énergie échangée Q est une grandeur algébrique qui est :
- positive lorsque le système reçoit effectivement de l'énergie ;
- négative lorsque le système cède effectivement de l'énergie.
Le signe de \color{black}Q permet de prévoir le sens du transfert thermique, qui spontanément s'effectue du corps qui a la température la plus élevée vers celui qui a la température la moins élevée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Application
On introduit dans un congélateur une bouteille en verre pleine d'eau liquide. Sa température passe de 20 °C à -12 °C. Que peut-on en conclure quant aux transferts thermiques avec l'extérieur ?
L'eau de la bouteille a initialement une température plus élevée que le congélateur : le transfert thermique s'effectue de la bouteille d'eau vers le congélateur. Ainsi, Q < 0 J puisque la bouteille d'eau cède de l'énergie à l'extérieur. En l'absence de travail mécanique sur l'eau, le premier principe s'écrit \Delta{U}= Q . Ainsi, \Delta{U} < 0 J. L'énergie interne de l'eau a donc diminué : cela est dû à une agitation moins forte des molécules à l'état solide qu'à l'état liquide.
Corrigé
L'eau de la bouteille a initialement une température plus élevée que le congélateur : le transfert thermique s'effectue de la bouteille d'eau vers le congélateur. Ainsi, Q < 0 J puisque la bouteille d'eau cède de l'énergie à l'extérieur. En l'absence de travail mécanique sur l'eau, le premier principe s'écrit \Delta{U}= Q . Ainsi, \Delta{U} < 0 J. L'énergie interne de l'eau a donc diminué : cela est dû à une agitation moins forte des molécules à l'état solide qu'à l'état liquide.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Transformation thermodynamique
Transformation thermodynamique : passage pour un système thermodynamique d'un état d'équilibre initial à un état d'équilibre final.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour des raisons historiques, le terme « transfert thermique » est parfois remplacé par « chaleur ». En physique, la chaleur est donc homogène à une énergie. C'est pourquoi le sens physique de ce terme ne correspond pas au sens commun de température élevée.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4 Bouteille en verre congelée


Lors du refroidissement de l'eau dans une bouteille, le système {bouteille + eau} cède de l'énergie à l'extérieur.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez une explication des modes de transfert thermique en vidéo :
Matthieu Colombel,
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
4Bilans d'énergie sur un système incompressible
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
ACapacité thermique et énergie interne
Soit un système incompressible, non soumis à un changement d'état et n'étant pas le siège de réactions chimiques ou nucléaires.
Lorsque la température d'un tel système évolue, il existe une relation de proportionnalité entre la variation de température \Delta{T} et la variation d'énergie interne \Delta{U} du système entre les états initial et final. Cette relation de proportionnalité est donnée par la capacité thermique C, qui est une grandeur qui s'exprime en (J⋅K-1) :
\color{black}\Delta{U} : variation d'énergie interne (J)
\color{black}m : masse du système (kg)
\color{black}c : capacité thermique massique (J⋅kg-1⋅K-1)
\color{black}\Delta{T} : variation de température (K)
\Delta{U} = C \cdot\Delta{T}
La capacité thermique du système dépend de la nature du corps, mais aussi de la quantité de matière présente dans le système. On définit ainsi c en (J⋅kg-1⋅K-1) la capacité thermique massique du système.
\color{black}\Delta{U} = m ⋅ c ⋅ \Delta{T}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Application
Ethan souhaite cuire des pâtes. Pour cela, il fait bouillir 1 L d'eau initialement à 20 °C dans une casserole recouverte d'un couvercle. On considère que toute l'énergie de la source chaude est transmise à l'eau. Déterminer l'énergie à apporter à l'eau, de capacité thermique c_\text{eau} = 4 185 J⋅kg-1⋅K-1, pour la porter à ébullition.
La température de l'eau varie de :
\Delta{T} = T_\text{f} - T_\text{i} :
AN : \Delta{T} = 373 - 293 = 80 K
\Delta{U} = \text{m}_\text{eau} \cdot \text{c}_\text{eau} \cdot \Delta{T}
\Delta{U} = \rho_{eau} ⋅ V ⋅ \text{c}_\text{eau} ⋅ \Delta{T}
AN : \Delta{U} = 1 000 \times 1{,}0 \times 10^{-3} \times 4{,}185 \times 10^3 \times 80 = 3{,}3 \times 10^5 J
Il faut ainsi apporter une énergie égale à 3,3 × 102 kJ pour porter l'eau à ébullition.
Corrigé
La température de l'eau varie de :
\Delta{T} = T_\text{f} - T_\text{i} :
AN : \Delta{T} = 373 - 293 = 80 K
\Delta{U} = \text{m}_\text{eau} \cdot \text{c}_\text{eau} \cdot \Delta{T}
\Delta{U} = \rho_{eau} ⋅ V ⋅ \text{c}_\text{eau} ⋅ \Delta{T}
AN : \Delta{U} = 1 000 \times 1{,}0 \times 10^{-3} \times 4{,}185 \times 10^3 \times 80 = 3{,}3 \times 10^5 J
Il faut ainsi apporter une énergie égale à 3,3 × 102 kJ pour porter l'eau à ébullition.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BBilan énergétique
S'il est possible de déterminer l'expression de l'énergie interne d'un système incompressible en fonction de la capacité thermique (et même l'expression du travail dans certains cas), l'expression de Q est, quant à elle, déduite à l'aide du premier principe.
Pour un système incompressible au sein duquel a lieu une transformation thermodynamique sans travail (\color{black}W = 0 J), le premier principe nous donne :
\color{black}Q = \Delta{U} = m \cdot c \cdot \Delta{T}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5 Verre soufflé


Le verre est un matériau qui a une capacité thermique massique relativement faible (c = 720 J⋅K-1⋅kg-1), rendant possible son travail à de hautes températures.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C_\text{m} = \dfrac{C}{n}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Système incompressible
Système incompressible : Système dont le volume demeure constant au cours d'une transformation. En pratique, on utilisera souvent cette hypothèse qui permet de considérer que la masse volumique \rho du système reste constante.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
L'expression obtenue pour Q n'est pas généralisable : en effet, dans le cas où le travail est non nul, le premier principe donne :
Q = \Delta{U} - W = m \cdot c \cdot \Delta{T} - W
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 6 Eau bouillante


L'énergie nécessaire pour porter à ébullition une eau dépend de sa masse et de la différence de température.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
