Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Chapitre 15
Exercices
Objectif Bac
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
37Cogénération en exploitation agricole
✔ VAL : Respecter le nombre de chiffres significatifs
✔ APP : Extraire l'information utile
✔ APP : Extraire l'information utile
D'après le sujet Bac S, Amérique du Nord, 2014.
La cogénération est la production simultanée d'énergie électrique et d'énergie thermique à partir d'un combustible dans un cogénérateur. Dans une exploitation agricole, le combustible peut être le biogaz.
Le GAEC Les Châtelets est une exploitation agricole de type élevage bovin. Ce GAEC a souhaité développer une structure de méthanisation-cogénération, mise en service à l'automne 2009 :
- puissance électrique du cogénérateur : 104 kW ;
- production annuelle d'énergie par le cogénérateur : thermique : 860 MW⋅h ; électrique : 830 MW⋅h ;
- efficacité énergétique globale : 70 \% (rapport de l'énergie totale produite par le cogénérateur à l'énergie issue de la combustion du biogaz) ;
- 200 L d'eau chaude sont consommés par jour dans la salle de traite.
D'après l'ADEME.
1. Calculer en (MW⋅h) la quantité d'énergie libérée en un an par la combustion du biogaz dans l'installation présentée.
2. En déduire l'ordre de grandeur du volume de biogaz correspondant, sachant que la combustion de 1 m3 de biogaz produit une énergie égale à 6 kW⋅h.
3. Déterminer, en (m3), le volume d'eau qui peut être chauffé de 10 °C à 70 °C chaque année grâce à l'énergie thermique produite par l'installation.
4. Justifier que l'on peut utiliser l'eau chaude produite pour la salle de traite et pour la consommation de plusieurs usagers.
Données
- Conversion d'unités : 1 kW⋅h = 3 600 kJ
- Capacité thermique massique de l'eau : c = 4 185 J⋅kg-1⋅K-1
- Masse volumique de l'eau : \rho = 1 000 kg⋅m-3
Détails du barème
TOTAL /5 pts
0,5 pt
1. Déterminer la quantité d'énergie libérée en un an.
0,5 pt
1. Tenir compte de l'efficacité énergétique pour le calcul de l'énergie issue de la combustion.
0,5 pt
2. Déterminer l'ordre de grandeur du volume de biogaz avec un seul chiffre significatif.
1 pt
3. Énoncer la relation \Delta{U} = \text{C} \cdot \Delta{T}, puis déterminer l'expression littérale du volume d'eau.
1,5 pt
3. Effectuer l'application numérique correcte avec deux chiffres significatifs.
1 pt
4. Calculer le volume utilisé annuellement dans la salle de traite et conclure.
➜ Retrouvez plus d'exercices dans le
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
38Décomposition du pentoxyde d'azote
✔ RAI/MOD : Modéliser une transformation
✔ REA : Utiliser un modèle
D'après le sujet Bac S, Réunion, 2010.
À température élevée, le pentoxyde d'azote, de formule \text{N}_2 \text{O}_5, se décompose selon l'équation de la réaction lente et totale suivante :
2\ \text{N}_2 \text{O}_5 (\text{g}) \longrightarrow 4\ \text{NO}_2 (\text{g}) + \text{O}_2 (\text{g})
On place du pentoxyde d'azote dans une enceinte fermée de volume V = 0{,}50 L à température constante T = 318 K. On mesure la pression p dans l'enceinte au cours du temps.
À t = 0, la pression dans l'enceinte est p_0 = 463{,}8 hPa. Les mesures sont notées dans le tableau suivant :
| t (s) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
| \dfrac{p}{p_0} | 1{,}000 | 1{,}435 | 1{,}703 | 2{,}047 | 2{,}250 | 2{,}358 | 2{,}422 |
La constante des gaz parfaits est R = 8{,}314 J⋅mol-1⋅K-1. On considère les gaz comme parfaits.
1. Déterminer la quantité de matière initiale de pentoxyde d'azote n_0.
2. En notant x l'avancement de la réaction, dresser le tableau d'avancement de la transformation étudiée.
3. Montrer que l'avancement maximal de la réaction a pour valeur x_{max} = 4{,}4 mmol.
4. Exprimer la quantité de matière totale de gaz n_g en fonction de n_0 et x.
5. En déduire la relation \dfrac{p}{p_0} = 1 + \dfrac{3 \text{x}}{n_0} .
6. Déterminer le rapport \dfrac{p_{max}}{p_0} où p_{max} est la pression dans l'enceinte à l'avancement maximal.
7. Justifier que la réaction n'est pas terminée à t = 100 s.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
39Fonctionnement d'une pompe à chaleur
✔ APP : Extraire l'information utile
✔ VAL : Analyser des résultats
D'après le sujet Bac S, Antilles, 2014.
I. Généralités sur la pompe à chaleur
Pour le chauffage d'une maison, une pompe à chaleur est utilisée. On évalue ses pertes thermiques : la masse m_\text{e} d'air à l'intérieur de la maison étant initialement à la température \theta_1 = 19{,}0 °C, le chauffage est coupé pendant une durée \Delta{t} = 1{,}00 h. On mesure une température \theta_2 = 15{,}6 °C.1. Exprimer, puis calculer la variation de l'énergie interne \Delta{U} de l'air contenu dans la maison.
2. Interpréter le signe du résultat obtenu.
3. Déterminer la puissance thermique P_{\text{th}} nécessaire au maintien d'une température constante (égale à 19,0 °C) de l'air à l'intérieur de cette maison.
4. En réalité, la puissance thermique que doit fournir la pompe à chaleur pour chauffer l'habitation est P'_\text{th} = 4{,}0 kW. Formuler une hypothèse pour expliquer l'écart avec la valeur trouvée à la question 3.
On utilise la valeur de 4{,}0 kW pour la suite de l'exercice.
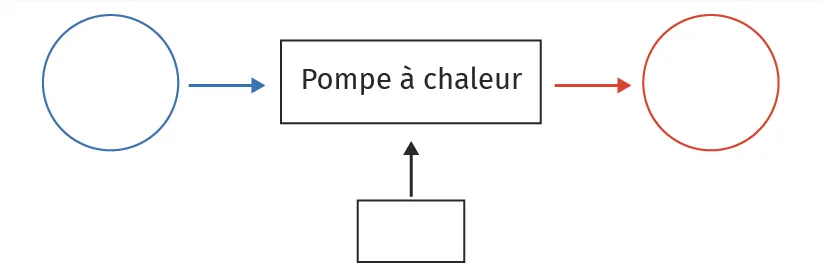
5. Préciser ce que l'on entend par « sens naturel » dans le Doc. 1 En déduire ce qu'il en est dans le cas de la pompe à chaleur. Compléter le schéma du Doc. 2 représentant le bilan énergétique de la pompe à chaleur en plaçant W, Q_C et Q_F et les sources en présence.
II. Performance de la pompe à chaleur
Le coefficient de performance COP d'une pompe à chaleur est défini par COP = \dfrac{Q_c}{W} .1. Justifier cette expression.
2. Sachant que la puissance thermique pour chauffer l'habitation est P'_{th} = 4{,}0 kW, déterminer le transfert thermique Q_C reçu par la pompe à chaleur pendant 24 h si l'on suppose que la pompe à chaleur fonctionne sans interruption.
3. Le coefficient de performance de la pompe à chaleur étudiée vaut 3,1. En déduire le travail électrique W reçu par le compresseur de la pompe à chaleur en une journée.
4. Calculer le coût journalier d'utilisation de cette pompe à chaleur.
5. Calculer le coût journalier pour cette même habitation si celle-ci était chauffée par des radiateurs électriques pour lesquels le coefficient de performance vaut 1. Conclure.
Données
- Capacité thermique massique de l'air : c = 1 000 J⋅kg-1⋅K-1
- Volume intérieur de la maison : V = 400 m3
- Masse volumique de l'air : \rho = 1{,}3 kg⋅m-3
- Coût du kW⋅h en France en 2013 : 0{,}13 €
Doc. 1
Pompe à chaleurLa pompe à chaleur (PAC) est destinée à assurer le chauffage à partir d'une source externe (l'air, le sol ou l'eau) dont la température est inférieure à celle du système à chauffer. La PAC réalise un transfert thermique d'un milieu froid vers un milieu chaud, c'est-à-dire inverse du sens naturel.
Pour réaliser ce transfert inverse, une dépense d'énergie est nécessaire. Elle correspond à un échange de travail W fourni par un compresseur à un fluide caloporteur, c'est-à-dire capable de s'écouler et permettant d'échanger de l'énergie avec les sources. Ce fluide, au contact de la source froide extérieure, absorbe de l'énergie qu'il restitue lors de son contact avec la source chaude. On fait donc décrire une série de transformations périodiques au fluide. On parle de « cycle thermodynamique ».
Dans les PAC à condensation, l'absorption et la restitution d'énergie par le fluide reposent sur le changement d'état de celui‑ci :
- son évaporation (passage du fluide de l'état liquide à l'état gazeux) permet l'absorption d'énergie lors du contact avec la source froide extérieure. L'énergie échangée est notée Q_F ;
- sa condensation (passage du fluide de l'état gazeux à l'état liquide) permet la restitution d'énergie lors du contact avec le local à chauffer. L'énergie échangée est notée Q_C.

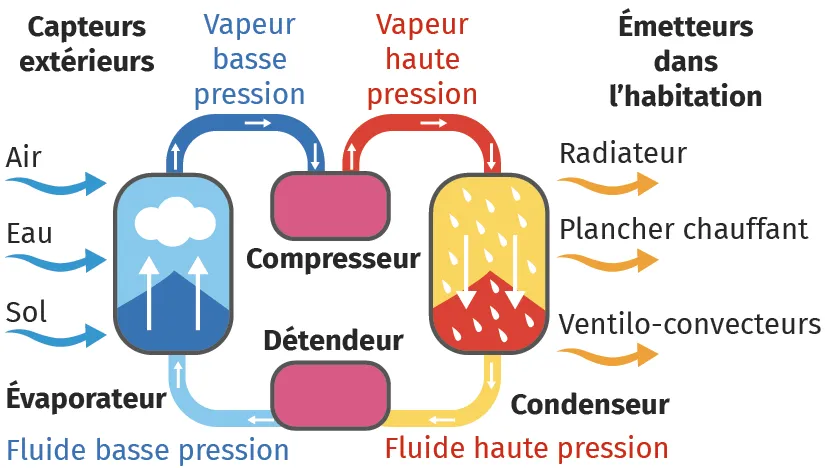
Doc. 2
Schéma à compléter
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
