Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Chapitre 15
Exercices
Pour s'échauffer - Pour commencer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
| Pour commencer | Différenciation | Pour s'entraîner | |
|---|---|---|---|
| Savoir exploiter l'équation d'état du gaz parfait pour décrire le comportement d'un gaz | |||
| Savoir exploiter l'équation d'état du gaz parfait pour déterminer une concentration ou une quantité de matière | |||
| Savoir prévoir le sens d'un transfert thermique | |||
| Savoir réaliser un bilan énergétique |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour s'échauffer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
5Interprétation de l'énergie interne
Rappeler les deux contributions, d'origine microscopique, à l'énergie interne U.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
6Variation de température
Rappeler le lien entre \Delta{T} et \Delta{U} pour un système incompressible, en précisant les unités et les hypothèses.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
7Inspiration, expiration
Au repos, un homme inspire environ 0,5 L d'air par cycle respiratoire. Déterminer la quantité d'air inspiré par cycle.
Données
- Constante des gaz parfaits : R = 8{,}314 J⋅K-1⋅mol-1
- Conditions du système : \rho = 1,013 bar et \theta = 20 °C
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
8Premier principe de la thermodynamique
1. Énoncer le premier principe de la thermodynamique.
2. Préciser quels sont les termes représentant une variation de l'énergie au cours de la transformation et ceux correspondant à des transferts d'énergie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
9Glaçon au congélateur
Un glaçon de 20 g voit sa température passer de -10 °C à -18 °C dans un congélateur.
Déterminer l'énergie reçue par le glaçon et commenter son signe. On donne c_\text{glace} = 2\ 060 J⋅kg-1⋅K-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
10Température corporelle
La capacité thermique d'un être humain moyen est C = 214 kJ⋅K-1. Les apports journaliers recommandés sont de 8 400 kJ.
Calculer l'élévation de température si l'on considère que l'énergie apportée sert uniquement à élever la température corporelle.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
11Fluide frigorigène
Le fluide frigorigène d'un réfrigérateur échange avec des aliments une énergie Q_1 = 104 kJ et échange avec l'extérieur une énergie Q_2 = -162 kJ.
En supposant sa variation d'énergie interne nulle, déterminer le travail mécanique W reçu par le fluide frigorigène du réfrigérateur.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Pour commencer
Variables d'état du gaz parfait
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
12Masse volumique
✔ REA : Utiliser un modèle
1. En assimilant l'air à un gaz parfait, déterminer l'expression littérale de la masse volumique \rho_{air} de l'air en fonction de la masse molaire M_{air} ainsi que de p, R et T.
2. Calculer sa valeur numérique dans les CNTP.
1. En assimilant l'air à un gaz parfait, déterminer l'expression littérale de la masse volumique \rho_{air} de l'air en fonction de la masse molaire M_{air} ainsi que de p, R et T.
2. Calculer sa valeur numérique dans les CNTP.
Données
- Constante des gaz parfaits : R = 8{,}314 J⋅K-1⋅mol-1
- Conditions normales de température et de pression (CNTP) : p = 1{,}013 bar et {\theta = 0} °C
- Masse molaire de l'air : M_{air} = 29,0 g⋅mol-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
13Volume molaire
✔ APP : Faire des prévisions à l'aide d'un modèle
Le volume molaire V_m d'un gaz est défini comme le volume occupé par une mole de ce gaz. Dans les unités du Système International, il s'exprime en (m3⋅mol-1), mais on l'exprime le plus souvent en (L⋅mol-1). On considère un gaz parfait dans les CNTP.
1. Déterminer son volume molaire V_m.
1. Déterminer son volume molaire V_m.
2. Préciser si le volume molaire dépend de la nature du
gaz.
3. En le justifiant, préciser si le modèle du gaz parfait est adapté pour de grandes ou de faibles valeurs de volume molaire.
3. En le justifiant, préciser si le modèle du gaz parfait est adapté pour de grandes ou de faibles valeurs de volume molaire.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Modèle du gaz parfait
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
14Autre formulation de l'équation d'état
✔ APP : Extraire l'information utile
Ludwig Boltzmann (1844-1906) introduit à la fin du XIXe siècle une constante, notée k_B, à laquelle il a donné son nom. Elle est reliée à la constante des gaz parfaits par la relation R = k_B\cdot N_A, avec N_A le nombre d'Avogadro.
Exprimer l'équation d'état des gaz parfaits en fonction notamment du nombre d'entités constitutives du gaz N et de la constante de Boltzmann k_B.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
15Attention au soroche !
✔ REA : Utiliser un modèle
Lié à la raréfaction du dioxygène, le soroche (ou mal aigu des montagnes) touche les personnes effectuant un séjour à haute altitude, sans acclimatation préalable.
1. En assimilant l'air à un gaz parfait à 15 °C, déterminer la masse volumique de l'air à 0 m et à 3 810 m d'altitude.
2. Exprimer sous la forme d'un pourcentage la variation de la quantité de dioxygène occupant 1 L d'air au niveau du lac Titicaca, par rapport au niveau de la mer.
Lié à la raréfaction du dioxygène, le soroche (ou mal aigu des montagnes) touche les personnes effectuant un séjour à haute altitude, sans acclimatation préalable.
1. En assimilant l'air à un gaz parfait à 15 °C, déterminer la masse volumique de l'air à 0 m et à 3 810 m d'altitude.
2. Exprimer sous la forme d'un pourcentage la variation de la quantité de dioxygène occupant 1 L d'air au niveau du lac Titicaca, par rapport au niveau de la mer.


Isla del Sol, lac Titicaca (3 810 m), Bolivie
Données
- Masse molaire de l'air : M = 29{,}0 g·mol-1
- Intensité de pesanteur : g = 9{,}81 N·kg-1
- Constante des gaz parfaits : R = 8{,}314 J⋅K-1⋅mol-1
- Pression atmosphérique au niveau de la mer : p_0 = 1 013 hPa
- Pression à 3 810 m d'altitude : p (3 810 m) = 628 hPa
- Composition de l'air jusqu'à 80 km d'altitude : 21 \% de dioxygène
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
16Ballon de baudruche au soleil
✔ COM : Rédiger un compte‑rendu scientifiquement rigoureux
On remplit un ballon de baudruche d'un gaz supposé parfait à une température égale à 20 °C.
En utilisant un vocabulaire scientifique précis, expliquer pourquoi il est déconseillé de laisser le ballon très gonflé en plein soleil.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Premier principe et transferts
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
17Glaçon dans un jus de fruits
✔ APP : Maîtriser le vocabulaire du cours
L'été, Maël aime ajouter un glaçon à son jus de fruits.
1. Sachant que le passage de l'état solide à l'état liquide est endothermique, préciser le signe de la variation d'énergie interne du glaçon \Delta{U}.
2. Dans cette question, on étudie le jus de fruits. Effectuer un bilan des transferts thermiques mis en jeu et déterminer leur sens.
Doc.
Transformation endothermique
Une transformation endothermique s'accompagne d'une absorption d'énergie. Autrement dit, c'est une transformation qui n'est possible que lorsqu'on lui apporte de l'énergie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
18Corps humain et premier principe
✔ APP : Extraire l'information utile
On souhaite étudier le corps humain d'un point de vue thermodynamique. Pour simplifier, on considère que l'être humain délivre un travail mécanique W_{\text{méca}} \lt 0 J et libère un transfert thermique Q \lt 0 J. La grandeur W_{\text{méca}} + Q permet au corps humain de réaliser son métabolisme. L'alimentation apporte au corps humain une énergie E_{\text{alim}}.
1. Donner le signe de E_{\text{alim}}. Commenter le signe des deux autres grandeurs.
2. En considérant que l'énergie interne du corps humain est constante, exprimer E_{\text{alim}} en fonction de W_{\text{méca}} et Q .
2. En considérant que l'énergie interne du corps humain est constante, exprimer E_{\text{alim}} en fonction de W_{\text{méca}} et Q .
3. En utilisant la valeur de la puissance métabolique, calculer W_{\text{méca}} + Q sur une durée de 24 h.
4. En déduire E_{\text{alim}}, puis l'exprimer en (kcal).
4. En déduire E_{\text{alim}}, puis l'exprimer en (kcal).
Doc.
Calorie
ur les étiquettes des produits alimentaires, les énergies sont le plus souvent exprimées en kilocalorie (kcal). La calorie est une unité définie comme l'énergie qu'il faut apporter à un 1 g d'eau à 14,5 °C pour élever sa température de 1 °C. On estime qu'un adulte a besoin de 2 000 kcal par jour.
Données
- Puissance métabolique : P = 100 W
- Conversion d'unités : 1 cal = 4{,}185 J
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
19En randonnée (1)
✔ REA : Appliquer une formule
Parties en randonnée, Thaïs et Yasmine se font du thé. Elles disposent d'un réchaud d'une puissance de 3 600 W. On suppose que 50 \% de l'énergie du réchaud est transférée à la masse m d'eau, considérée comme un système incompressible.
1. Déterminer la valeur de l'énergie Q reçue par l'eau pour faire passer sa température de \theta_i à \theta_f.
Parties en randonnée, Thaïs et Yasmine se font du thé. Elles disposent d'un réchaud d'une puissance de 3 600 W. On suppose que 50 \% de l'énergie du réchaud est transférée à la masse m d'eau, considérée comme un système incompressible.
1. Déterminer la valeur de l'énergie Q reçue par l'eau pour faire passer sa température de \theta_i à \theta_f.
2. Déterminer la durée de cette transformation.
Données
- Capacité thermique massique de l'eau : c = 4 185 J⋅kg-1⋅K-1
- Masse d'eau dans le réchaud : m_{\text{eau}} = 1,5 kg
- Températures considérées : \theta_i = 20 °C et \theta_f = 90 °C
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
20En randonnée (2)
✔ REA : Appliquer une formule
La paroi interne d'une bouteille isotherme a une capacité thermique égale à C = 40 J⋅K-1. Nicolas remplit sa bouteille avec une masse m = 750 g de café avant de partir en randonnée. On assimile le café à de l'eau.
1.
Déterminer la capacité thermique totale du système fermé {paroi interne de la bouteille + café}.
2. Finalement, Nicolas n'a pas bu de café. Ce système a vu sa température chuter de 30 °C.
Déterminer l'énergie Q cédée par le système.
Déterminer l'énergie Q cédée par le système.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
21Piscine municipale
✔ APP : Maîtriser le vocabulaire du cours
On souhaite remplir le bassin d'une piscine de 500 m3 d'eau à une température de \theta_\text{p} = 28 °C. On ne dispose que d'une arrivée d'eau froide à \theta_\text{f} = 20 °C et d'une arrivée d'eau chaude à \theta_\text{c} = 60 °C. On simplifie le calcul en considérant que l'eau, une fois dans le bassin, se comporte comme un système isolé.
1. Déterminer la relation entre la variation d'énergie interne de l'eau froide \Delta{U_\text{f}} et la variation d'énergie interne de l'eau chaude \Delta{U_\text{c}} entre leur état initial et l'état final.
1. Déterminer la relation entre la variation d'énergie interne de l'eau froide \Delta{U_\text{f}} et la variation d'énergie interne de l'eau chaude \Delta{U_\text{c}} entre leur état initial et l'état final.
2. En déduire les masses d'eau à mélanger.
Données
- Capacité thermique massique de l'eau : c = 4,18 kJ⋅kg-1⋅K-1
- Masse volumique de l'eau : \rho = 998 kg⋅m-3
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
APremier principe et gaz parfait
✔ RAI/MOD : Utiliser avec rigueur le modèle de l'énergie
Un gaz parfait vérifie la première loi de Joule, c'est-à-dire que son énergie interne ne dépend que de sa température. Le fonctionnement de nombreuses machines thermiques est cyclique, c'est‑à‑dire que le gaz retrouve sa température initiale à la fin d'un cycle.
Le gaz est le système thermodynamique fermé étudié.
En déduire la valeur de la somme W + Q sur un cycle.
Le gaz est le système thermodynamique fermé étudié.
En déduire la valeur de la somme W + Q sur un cycle.
Histoire des sciences
La calorimétrie fut inventée par Joseph Black (1728‑1799) qui découvrit également le dioxyde de carbone.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BCapacité thermique du fer
✔ RAI/ANA : Élaborer un protocole
On dispose d'un calorimètre, d'un morceau de fer chauffé, de masse connue précisément, et d'eau.
Proposer un protocole permettant de déterminer la capacité thermique massique du fer
On dispose d'un calorimètre, d'un morceau de fer chauffé, de masse connue précisément, et d'eau.
Proposer un protocole permettant de déterminer la capacité thermique massique du fer
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
CExpérience de Joule
✔ RAI/MOD : Utiliser avec rigueur le modèle de l'énergie
Au milieu du XIXe siècle, le physicien britannique J. Joule fut le premier à démontrer l'équivalence entre travail et transfert de chaleur. Son expérience consiste à agiter de l'eau dans une enceinte calorifugée en actionnant une roue à aube grâce à un poids qu'on laisse tomber.
L'enceinte calorifugée empêche tout échange de chaleur entre l'eau et l'extérieur.

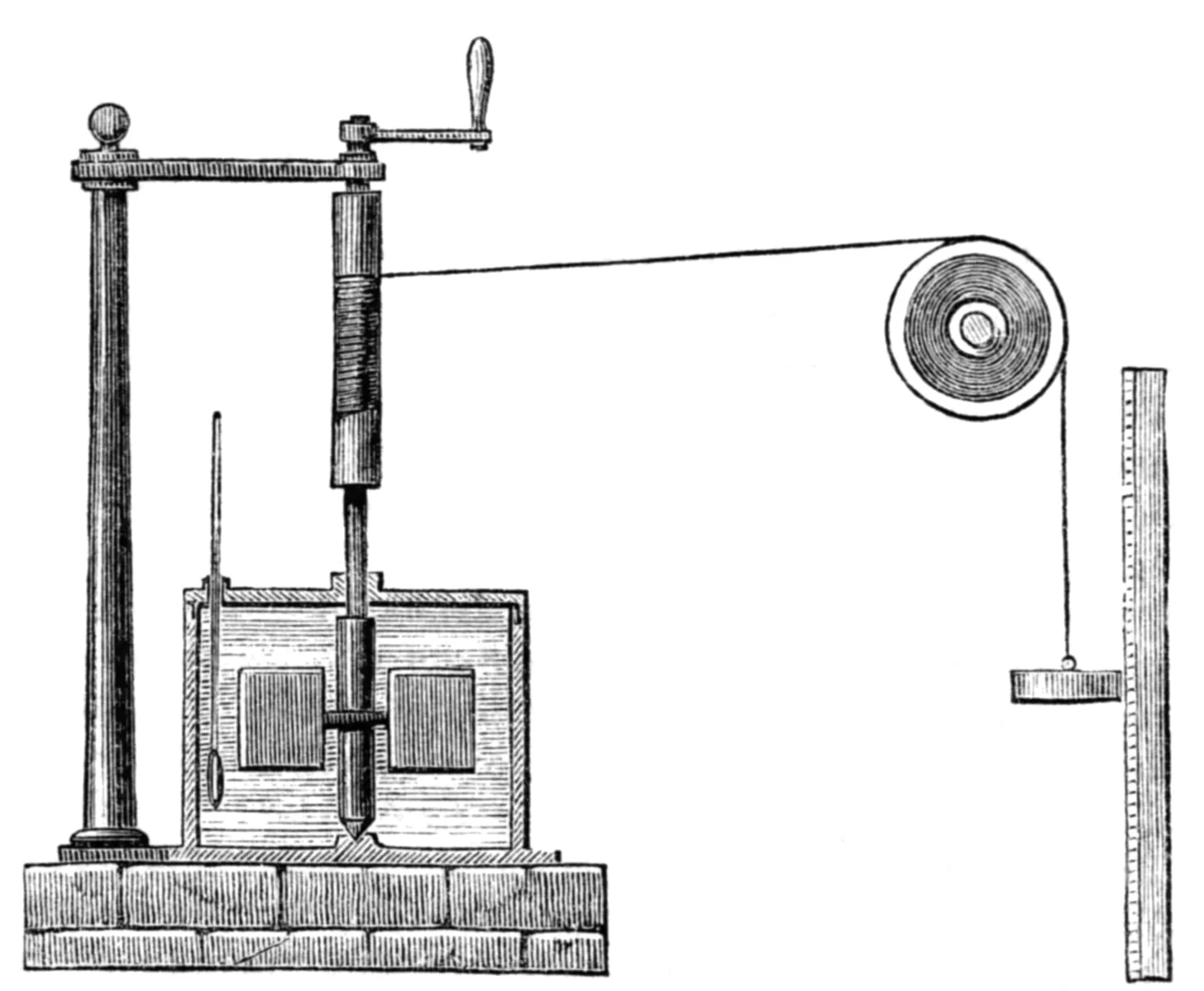
Au milieu du XIXe siècle, le physicien britannique J. Joule fut le premier à démontrer l'équivalence entre travail et transfert de chaleur. Son expérience consiste à agiter de l'eau dans une enceinte calorifugée en actionnant une roue à aube grâce à un poids qu'on laisse tomber.
L'enceinte calorifugée empêche tout échange de chaleur entre l'eau et l'extérieur.


À l'aide du premier principe de la thermodynamique, déterminer l'élévation de température mesurée pour une masse de 8,0 kg tombant d'une hauteur de 50,0 m.
Données
- Intensité de pesanteur terrestre : g = 9{,}81 N·kg-1
- Capacité thermique massique de l'eau liquide : c_{eau} = 4{,}18 kJ·kg-1·K-1
- Masse volumique de l'eau : \rho = 1{,}0 \times 10^3 kg·m-3
- Volume de l'enceinte : V = 0{,}50 L
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
DChaleur latente de vaporisation
✔ VAL : Exploiter des résultats
La chaleur latente de vaporisation L_{vap} correspond à l'énergie massique nécessaire pour la vaporisation d'un liquide E = L_{vap} \cdot m. Afin de mesurer cette valeur pour l'eau, on réalise l'expérience suivante.
On place une certaine quantité d'eau dans une enceinte calorifugée mais non hermétique posée sur une balance. Puis on plonge une résistance électrique qui chauffe l'eau par effet Joule. On agite l'eau en permanence afin que la température soit la plus homogène possible. Lorsque la température n'augmente plus, on lance un chronomètre et on relève la valeur de la masse. Au bout d'une durée \Delta t, on relève à nouveau la valeur de la masse.
La chaleur latente de vaporisation L_{vap} correspond à l'énergie massique nécessaire pour la vaporisation d'un liquide E = L_{vap} \cdot m. Afin de mesurer cette valeur pour l'eau, on réalise l'expérience suivante.
On place une certaine quantité d'eau dans une enceinte calorifugée mais non hermétique posée sur une balance. Puis on plonge une résistance électrique qui chauffe l'eau par effet Joule. On agite l'eau en permanence afin que la température soit la plus homogène possible. Lorsque la température n'augmente plus, on lance un chronomètre et on relève la valeur de la masse. Au bout d'une durée \Delta t, on relève à nouveau la valeur de la masse.
1. À l'aide du premier principe de la thermodynamique, exprimer L_{vap} en fonction de la perte de masse \Delta m, de la puissance dissipée par effet Joule P et de la durée \Delta t de l'expérience.
2. Calculer la chaleur latente de vaporisation de l'eau L_{vap}.
2. Calculer la chaleur latente de vaporisation de l'eau L_{vap}.
3. La valeur tabulée est L_{vap, tab} = 2{,}26 \times 10^3 J·g-1. Comment expliquer l'écart avec la valeur mesurée ?
Données
- Puissance électrique dissipée par effet Joule : P = 54 W
- Variation de masse : \Delta m = 13{,}5 g
- Durée de l'expérience : \Delta t = 630 s
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Une notion, trois exercices
Différenciation
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
22
Anniversaire
✔ REA : Utiliser un modèle
Lou a gonflé des ballons avec de l'hélium pour son anniversaire. Chaque ballon a une forme sphérique et est gonflé à température \theta_0 et à pression p_0.
Lou a gonflé des ballons avec de l'hélium pour son anniversaire. Chaque ballon a une forme sphérique et est gonflé à température \theta_0 et à pression p_0.
Données
- Conditions du système : \theta_0 = 19 °C et p_0 = 1 bar
- Diamètre d'un ballon : d = 20 cm
- Constante des gaz parfaits : R = 8{,}314 J⋅mol-1⋅K-1
1. Convertir les données en (K) et en (Pa).
2. Déterminer le volume d'un ballon.
2. Déterminer le volume d'un ballon.
3. Rappeler l'équation d'état du gaz parfait.
4. Calculer la quantité de matière de gaz dans un ballon.
4. Calculer la quantité de matière de gaz dans un ballon.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
23
Anniversaire
✔ VAL : Respecter le nombre de chiffres significatifs
Mathéo utilise une bombe aérosol pour faire des décorations pour son anniversaire. Le gaz propulseur est du diazote : il occupe 250 mL sous 4{,}0 bar, à 20 °C.
1. Déterminer la quantité de matière de diazote.
2. Mathéo laisse sa bombe en plein soleil, à une
température de 40 °C. Calculer la pression du gaz.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
24
Anniversaire
✔ RAI/ANA : Construire un raisonnement
Pour son anniversaire, Emmanuelle allume des bougies dans des pots. Mais son ami Alain ferme alors un pot avec un couvercle. La bougie s'éteint une fois le dioxygène épuisé.
Déterminer la quantité de matière de paraffine \text{C}_{16}\text{H}_{34} consommée après qu'Alain a posé le couvercle.
2\ \text{C}_{16}\text{H}_{34} (\text{s})+ 49\ \text{O}_2 (\text{g}) \longrightarrow 32\ \text{CO}_2 (\text{g}) + 34\ \text{H}_2\text{O} (\text{l})
Déterminer la quantité de matière de paraffine \text{C}_{16}\text{H}_{34} consommée après qu'Alain a posé le couvercle.
Données
- Conditions ambiantes : \theta = 20 °C et p = 1 bar
- Composition de l'air : 21 \% de dioxygène
- Volume du pot : V_{\text{pot}} = 300 mL
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
