Physique-Chimie 1re Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Composition chimique d'un système
Ch. 2
Composition chimique des solutions
Ch. 3
Évolution d'un système chimique
Ch. 4
Réactions d'oxydoréduction
Ch. 5
Détermination d'une quantité de matière par titrage
Livret Bac : Thème 1
Ch. 6
De la structure à la polarité d'une entité
Ch. 7
Interpréter les propriétés d’une espèce chimique
Ch. 8
Structure des entités organiques
Ch. 9
Synthèse d'espèces chimiques organiques
Ch. 10
Conversions d'énergie au cours d'une combustion
Livret Bac : Thème 1 bis
2. Mouvement et interactions
Ch. 11
Modélisation d'interactions fondamentales
Ch. 12
Description d'un fluide au repos
Ch. 13
Mouvement d'un système
Livret Bac : Thème 2
3. L'énergie, conversions et transferts
Ch. 14
Études énergétiques en électricité
Ch. 15
Études énergétiques en mécanique
Livret Bac : Thème 3
4. Ondes et signaux
Ch. 16
Ondes mécaniques
Ch. 17
Images et couleurs
Ch. 18
Modèles ondulatoire et particulaire de la lumière
Livret Bac : Thème 4
Méthode
Fiches méthode
Fiche méthode compétences
Annexes
Chapitre 2
Bilan
Composition chimique des solutions
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Principales notions
La concentration d'une espèce chimique en solution peut s'exprimer de deux façons :
c=\dfrac{n_{\text { soluté }}}{V_{\text {solution }}} (en mol·L-1) ou \gamma=\dfrac{m_{\text { soluté }}}{V_{\text {solution }}} (en g·L-1).
Elles sont liées par la relation : \gamma=c \cdot M.
Avec m_\text{ soluté} en g, n_{\text { soluté }} en mol, V_{\text {solution }} en L et M en g·mol-1.

c=\dfrac{n_{\text { soluté }}}{V_{\text {solution }}} (en mol·L-1) ou \gamma=\dfrac{m_{\text { soluté }}}{V_{\text {solution }}} (en g·L-1).
Elles sont liées par la relation : \gamma=c \cdot M.
Avec m_\text{ soluté} en g, n_{\text { soluté }} en mol, V_{\text {solution }} en L et M en g·mol-1.


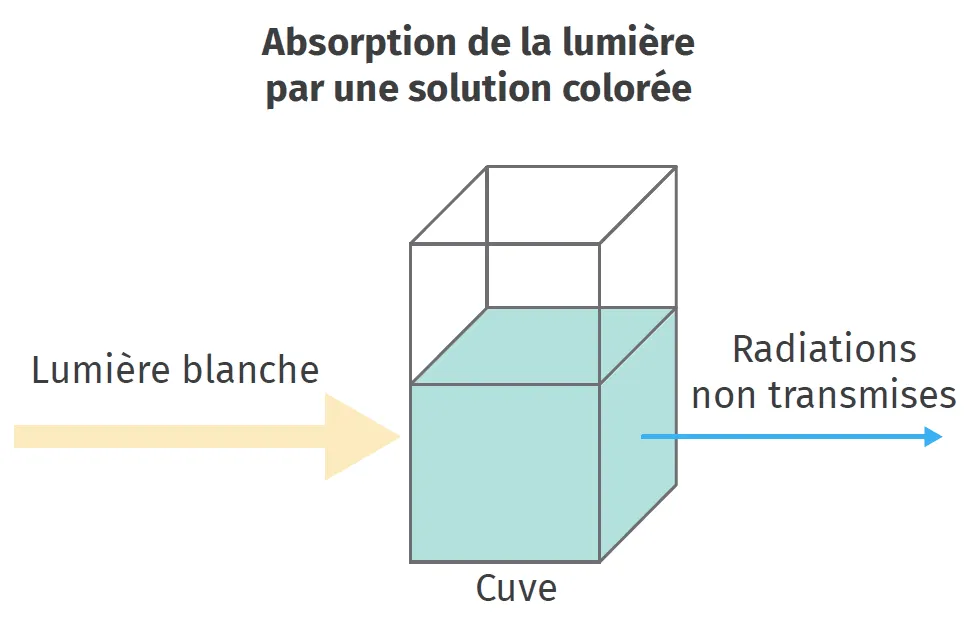
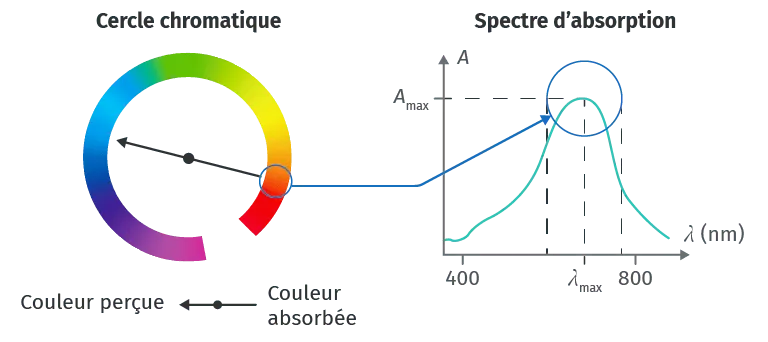
Une espèce chimique peut être caractérisée par son spectre d'absorption qui représente l'évolution de l'absorbance en fonction des longueurs d'onde des radiations qui la traversent.



Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les éléments essentiels de la modélisation
Pour une longueur d'onde donnée, l'absorbance d'une espèce chimique colorée en solution est proportionnelle à la concentration de cette espèce chimique.
La loi de Beer-Lambert s'écrit :
A_{\lambda}=k \cdot c=\epsilon_{\lambda} \cdot l \cdot c
avec A_{\lambda} sans unité, \epsilon_{\lambda} en L·mol-1·cm-1, l en cm et c en mol·L-1.
La loi de Beer-Lambert s'écrit :
A_{\lambda}=k \cdot c=\epsilon_{\lambda} \cdot l \cdot c
avec A_{\lambda} sans unité, \epsilon_{\lambda} en L·mol-1·cm-1, l en cm et c en mol·L-1.
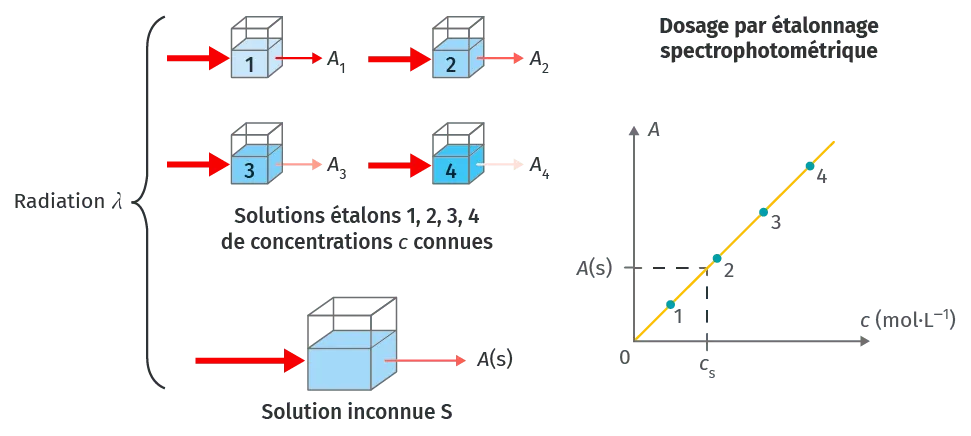
Cette propriété permet de doser une espèce chimique par étalonnage spectrophotométrique.



Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Les limites de la modélisation
Les conditions de validité de la loi de Beer-Lambert sont les suivantes :
- les espèces chimiques présentes en solution ne doivent pas réagir ensemble ;
- la solution doit être homogène ;
- la radiation incidente doit être monochromatique ;
- la radiation incidente ne doit pas faire réagir les espèces chimiques en solution ;
- les valeurs d'absorbance ne doivent pas être trop importantes (la valeur 1 est communément admise comme limite).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Réalisez une et reprenez les principales notions du chapitre !
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
