Physique-Chimie 1re Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Composition chimique d'un système
Ch. 2
Composition chimique des solutions
Ch. 3
Évolution d'un système chimique
Ch. 4
Réactions d'oxydoréduction
Ch. 5
Détermination d'une quantité de matière par titrage
Livret Bac : Thème 1
Ch. 6
De la structure à la polarité d'une entité
Ch. 7
Interpréter les propriétés d’une espèce chimique
Ch. 8
Structure des entités organiques
Ch. 9
Synthèse d'espèces chimiques organiques
Ch. 10
Conversions d'énergie au cours d'une combustion
Livret Bac : Thème 1 bis
2. Mouvement et interactions
Ch. 11
Modélisation d'interactions fondamentales
Ch. 12
Description d'un fluide au repos
Ch. 13
Mouvement d'un système
Livret Bac : Thème 2
3. L'énergie, conversions et transferts
Ch. 14
Études énergétiques en électricité
Ch. 15
Études énergétiques en mécanique
Livret Bac : Thème 3
4. Ondes et signaux
Ch. 16
Ondes mécaniques
Ch. 17
Images et couleurs
Ch. 18
Modèles ondulatoire et particulaire de la lumière
Livret Bac : Thème 4
Méthode
Fiches méthode
Fiche méthode compétences
Annexes
Chapitre 2
Problèmes à résoudre
Composition chimique des solutions
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
30Alcoolémie
✔ RAI/ANA : Construire un raisonnement
L'alcoolémie A d'un automobiliste, en g·L-1, peut se calculer avec la relation suivante :
Avec V le volume du verre d'alcool en mL ; d le degré d'alcool (%) ; K le coefficient de diffusion (0,70 pour un homme, 0,60 pour une femme) et m la masse de la personne en kg. Un automobiliste de 75 kg ayant son permis depuis un an et demi est contrôlé positif et doit subir une analyse de sang. Le résultat de l'analyse donne une concentration en alcool (éthanol \text{C}_{2}\text{H}_{6}\text{O}) de c = 3,0 \times 10-2 mol·L‑1.
A=\dfrac{0\text{,}80 \mathrm{V} \cdot d}{K \cdot m}
Avec V le volume du verre d'alcool en mL ; d le degré d'alcool (%) ; K le coefficient de diffusion (0,70 pour un homme, 0,60 pour une femme) et m la masse de la personne en kg. Un automobiliste de 75 kg ayant son permis depuis un an et demi est contrôlé positif et doit subir une analyse de sang. Le résultat de l'analyse donne une concentration en alcool (éthanol \text{C}_{2}\text{H}_{6}\text{O}) de c = 3,0 \times 10-2 mol·L‑1.
1. Calculer la concentration en masse d'éthanol.
2. Il affirme pourtant n'avoir bu que deux verres de vin (volume d'un verre V_\text{verre} = 100 mL) à 8° (d = 0,080). Cela est-il plausible ?
3. S'il n'avait bu que ce qu'il affirme, ce jeune conducteur aurait-il pu encourir une sanction ?
2. Il affirme pourtant n'avoir bu que deux verres de vin (volume d'un verre V_\text{verre} = 100 mL) à 8° (d = 0,080). Cela est-il plausible ?
3. S'il n'avait bu que ce qu'il affirme, ce jeune conducteur aurait-il pu encourir une sanction ?
Doc. 1
Données légales
En France, il est interdit de conduire avec une alcoolémie supérieure à 0,5 g d'alcool par litre de sang (0,2 g·L-1 pour les permis probatoires). Les permis probatoires concernent notamment les jeunes conducteurs ayant passé leur permis il y a moins de 3 ans (ou 2 ans en cas de conduite accompagnée).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
31Mildiou et bouillie bordelaise
✔ RAI/ANA : Construire un raisonnement


Feuille de vigne touchée par le mildiou.
La bouillie bordelaise est un mélange d'eau, de sulfate de cuivre (II) et de chaux éteinte, qui donne une bouillie bleu-verdâtre. Elle est utilisée en la pulvérisant sur les feuilles et les fruits. C'est un traitement préventif contre le mildiou, une maladie affectant de nombreuses espèces de plantes. Elle peut prendre des proportions épidémiques dans certaines cultures, comme la vigne.
Un vigneron possède 50,0 hectares de vignes. Il souhaite préparer sa bouillie bordelaise annuelle. Il doit pour cela se procurer du sulfate de cuivre pentahydraté \text{CuSO}_{4}, 5 \text{H}_{2}\text{O} et de la chaux éteinte \text{Ca(OH)}_{2}.
Quel est le coût de cette préparation pour le vigneron
s'il envisage de traiter toutes ses vignes ?
Données
- 1 ha = 1 \times 104 m2 ;
- 10 kg de sulfate de cuivre pentahydraté : 45 € ;
- 15 kg de chaux éteinte : 10 € ;
- Prix du m3 d'eau : 4 € ;
- Limite maximale de bouillie bordelaise dans un champ :
115 mL par m2 pour une concentration en sulfate de cuivre pentahydraté de 80,0 mmol·L^{-1} et en eau de chaux éteinte de 0,405 mol·L-1.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retour sur l'ouverture du chapitre (esprit scientifique)
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32Le stylo effaçable par friction
✔ RAI/ANA : Construire un raisonnement
Après plusieurs années de développement, une entreprise japonaise a finalement réussi à commercialiser un stylo dont l'encre liquide s'efface en frottant la feuille de papier avec un morceau de plastique. L'encre de ces stylos est thermosensible, c'est-à-dire qu'elle change de couleur avec la température : on parle de thermochromisme.
1. Pour un stylo dont l'encre est bleue, représenter l'allure du spectre d'absorption que l'on obtiendrait pour une solution diluée de cette encre.
1. Pour un stylo dont l'encre est bleue, représenter l'allure du spectre d'absorption que l'on obtiendrait pour une solution diluée de cette encre.
Cliquez pour accéder à une zone de dessin
2. Comment évolue le spectre d'absorption de l'encre quand on la chauffe ?
3. Comment est-il possible de faire réapparaître l'encre du stylo ?

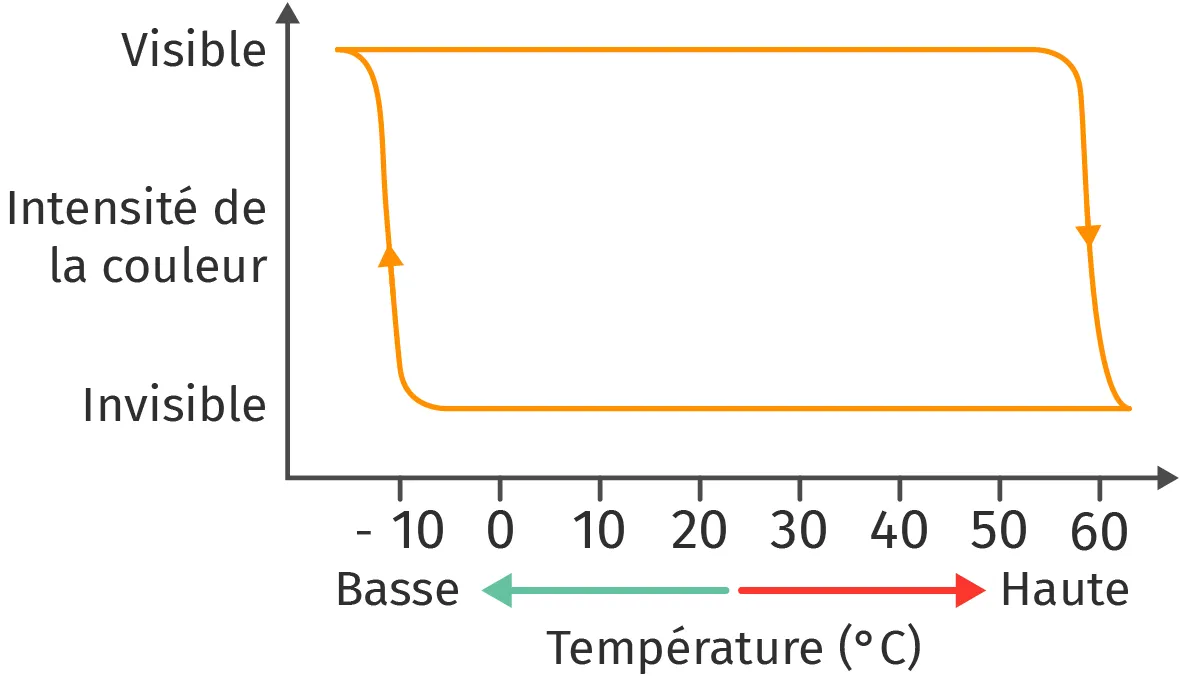
3. Comment est-il possible de faire réapparaître l'encre du stylo ?


Visibilité de l'encre selon la température
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
