Physique-Chimie Terminale Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Préparation aux épreuves du Bac
1. Constitution et transformations de la matière
Ch. 1
Modélisation des transformations acide-base
Ch. 2
Analyse physique d'un système chimique
Ch. 3
Méthode de suivi d'un titrage
Ch. 4
Évolution temporelle d'une transformation chimique
Ch. 5
Évolution temporelle d'une transformation nucléaire
BAC
Thème 1
Ch. 6
Évolution spontanée d'un système chimique
Ch. 7
Équilibres acide-base
Ch. 8
Transformations chimiques forcées
Ch. 9
Structure et optimisation en chimie organique
Ch. 10
Stratégies de synthèse
BAC
Thème 1 bis
2. Mouvement et interactions
Ch. 11
Description d'un mouvement
Ch. 12
Mouvement dans un champ uniforme
Ch. 13
Mouvement dans un champ de gravitation
Ch. 14
Modélisation de l'écoulement d'un fluide
BAC
Thème 2
3. Conversions et transferts d'énergie
Ch. 15
Étude d’un système thermodynamique
Ch. 16
Bilans d'énergie thermique
BAC
Thème 3
4. Ondes et signaux
Ch. 17
Propagation des ondes
Ch. 18
Interférences et diffraction
Ch. 19
Lunette astronomique
Ch. 20
Effet photoélectrique et enjeux énergétiques
Ch. 21
Évolutions temporelles dans un circuit capacitif
BAC
Thème 4
Annexes
Ch. 22
Méthode
Chapitre 8
Activité 2 - Activité expérimentale
90 min
Transformation spontanée et forcée
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Objectifs : Modéliser et schématiser les transferts d'électrons aux électrodes.
Identifier les produits lors d'une électrolyse.
Identifier les produits lors d'une électrolyse.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Problématique de l'activité
Si un oxydant et un réducteur réagissent lorsqu'ils sont mis en contact, on parle de transformation spontanée. Dans le sens inverse, la transformation n'est pas spontanée : elle doit être forcée.
Comment inverser le sens d'évolution d'un système oxydant‑réducteur ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Schéma de l'électrolyse

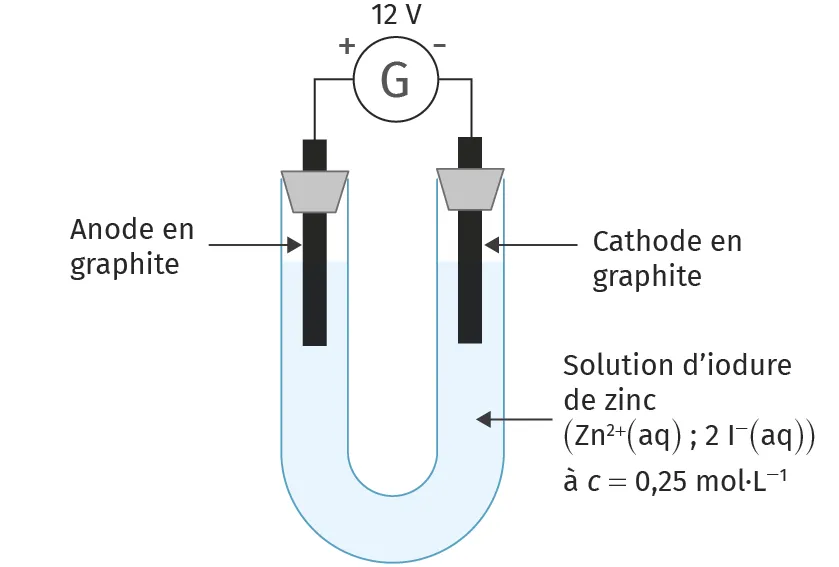
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Matériel nécessaire
- Tubes à essai
- Poudre de zinc \text{Zn(s)}
- Solution de sulfate de zinc à [\text{Zn}^{2+}] = 1{,}0 \times 10^{-2} mol·L-1
- Solution d'eau iodée [\text{I}_2] = 1{,}0 \times 10^{-3} mol·L-1
- Solution d'iodure de potassium [\text{I}^-] = 1{,}0 \times 10^{-2} mol·L-1
- Flacon test caractéristique de soude
- Tube en U, électrodes de graphite, générateur, fils de connexion
- Solution d'iodure de zinc de concentration c = 0{,}25 mol·L-1
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Aspect visuel des espèces chimiques
| Espèce chimique | Aspect |
|---|---|
| \text{Zn}^{2+}(\text{aq}) | Incolore |
| \text{Zn(s)} | Métal gris |
| \text{I}_2(\text{aq}) | Jaune |
| \text{I}^-(\text{aq}) | Incolore |
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Couples d'oxydoréduction : \text{Zn}^{2+}(\text{aq})/\text{Zn(s)} et \text{I}_2(\text{aq}) /\text{I}^-(\text{aq})
- Test de reconnaissance des ions \text{Zn}^{2+}(\text{aq}) : précipité blanc en présence de soude (\text{Na}^+(\text{aq}) ; \text{HO}^-(\text{aq}))
- Constante d'équilibre de la réaction spontanée entre les deux couples d'oxydoréduction : K_1 = 6 \times 10^{46}
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Questions
Compétence(s)
APP : Extraire l'information utile
RAI/MOD : Modéliser une transformation
COM : Rédiger un compte‑rendu scientifiquement rigoureux
REA : Mettre en œuvre un protocole
RAI/MOD : Modéliser une transformation
COM : Rédiger un compte‑rendu scientifiquement rigoureux
REA : Mettre en œuvre un protocole
1. a. Déterminer expérimentalement le sens d'évolution spontanée entre les espèces des deux couples étudiés. Schématiser les expériences et les interpréter.
b. Écrire l'équation de la transformation spontanée observée.
c. Calculer le quotient de réaction à l'état initial Q_{\text{r,i}} et montrer que le sens d'évolution trouvé correspond à celui prévisible théoriquement.
Cliquez pour accéder à une zone de dessin
b. Écrire l'équation de la transformation spontanée observée.
c. Calculer le quotient de réaction à l'état initial Q_{\text{r,i}} et montrer que le sens d'évolution trouvé correspond à celui prévisible théoriquement.
2. Réaliser le montage correspondant au doc. 1 et compléter le schéma en indiquant le déplacement des porteurs de charges (électrons et ions). Pour écrire sur ce schéma, veuillez cliquer sur l'image et utiliser notre outil de dessin.
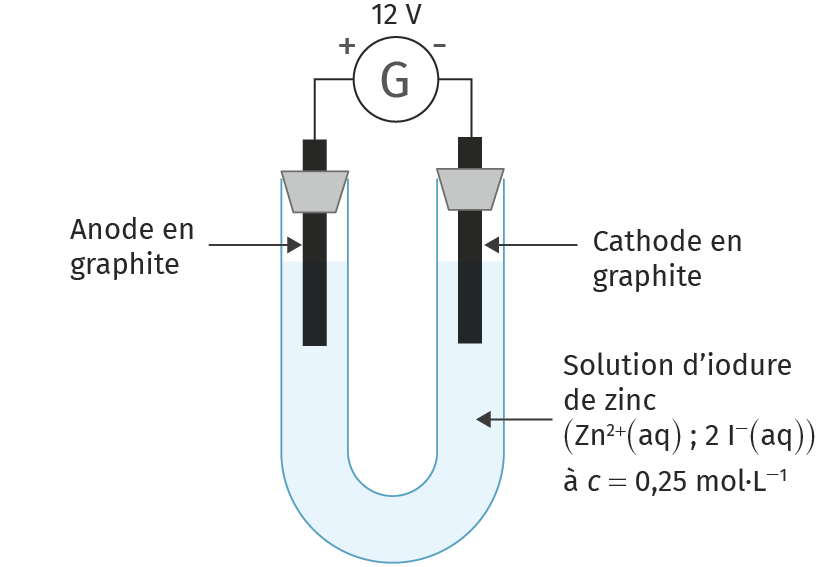
3. Interpréter les observations faites lors de l'électrolyse pour trouver les produits formés.
4. Écrire les demi‑équations modélisant les réactions électrochimiques aux électrodes et en déduire l'équation de la réaction globale. Commenter le sens de cette réaction.
5. Préciser le type de réaction électrochimique qui a lieu à l'anode.
6. Calculer la constante d'équilibre K_2 et Q'_{\text{r, i}} et commenter son évolution.

Dessinez ici
3. Interpréter les observations faites lors de l'électrolyse pour trouver les produits formés.
4. Écrire les demi‑équations modélisant les réactions électrochimiques aux électrodes et en déduire l'équation de la réaction globale. Commenter le sens de cette réaction.
5. Préciser le type de réaction électrochimique qui a lieu à l'anode.
6. Calculer la constante d'équilibre K_2 et Q'_{\text{r, i}} et commenter son évolution.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Synthèse de l'activité
Justifier l'emploi des termes « transformations chimiques forcées ».
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
