Enseignement scientifique 1re - 2023
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
Esprit critique
Une longue histoire de la matière
Ch. 1
Les éléments chimiques
Ch. 2
Les cristaux, des édifices ordonnés
Ch. 3
Une structure complexe : la cellule
Le Soleil, notre source d'énergie
Ch. 4
Le rayonnement solaire
Ch. 5
Le bilan radiatif terrestre
Ch. 6
Énergie solaire, photosynthèse et nutrition
Ch. 7
Énergie solaire et humanité
La Terre, un astre singulier
Ch. 8
La forme de la Terre
Ch. 9
L’Histoire de l'âge de la Terre
Ch. 10
La Terre dans l'Univers
Son et musique, porteurs d'information
Ch. 11
Son et musique
Ch. 12
Le son, une information à coder
Ch. 13
Entendre et protéger son audition
Projet expérimental et numérique
Livret Maths
Annexes
Chapitre 2
Cours
Les cristaux, des édifices ordonnées
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Les structures cristallines des solides
ADes solides cristallins ou amorphes
- On appelle solide tout système qui possède une forme propre.
- On distingue les solides cristallins constitués d'une répétition quasi parfaite d'arrangements d'entités chimiques (atomes, ions, molécules) dans les trois directions de l'espace et les solides amorphes correspondant à un état liquide figé et pour lesquels il n'y a pas d'ordre au-delà d'une échelle moléculaire.
BDe la structure cristalline à la masse volumique
- On appelle maille l'unité de répétition d'un cristal par translation. En se répétant indéfiniment dans les trois dimensions de l'espace, elle définit le réseau cristallin. Sa forme la plus simple est celle d'un cube de côté a appelé paramètre de maille.
- Connaissant le nombre d'entités appartenant à la maille et leurs masses, il est possible de remonter à des propriétés macroscopiques du solide cristallin comme sa masse volumique \rho :
\rho=\frac{m_{\text {entités }}}{V_{\text {maille }}}\rho : masse volumique (kg·m-3)
V_{\text {maille }} : volume de la maille (m3)
m_{\text {entités }} : masse des entités constituant la maille (kg)
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
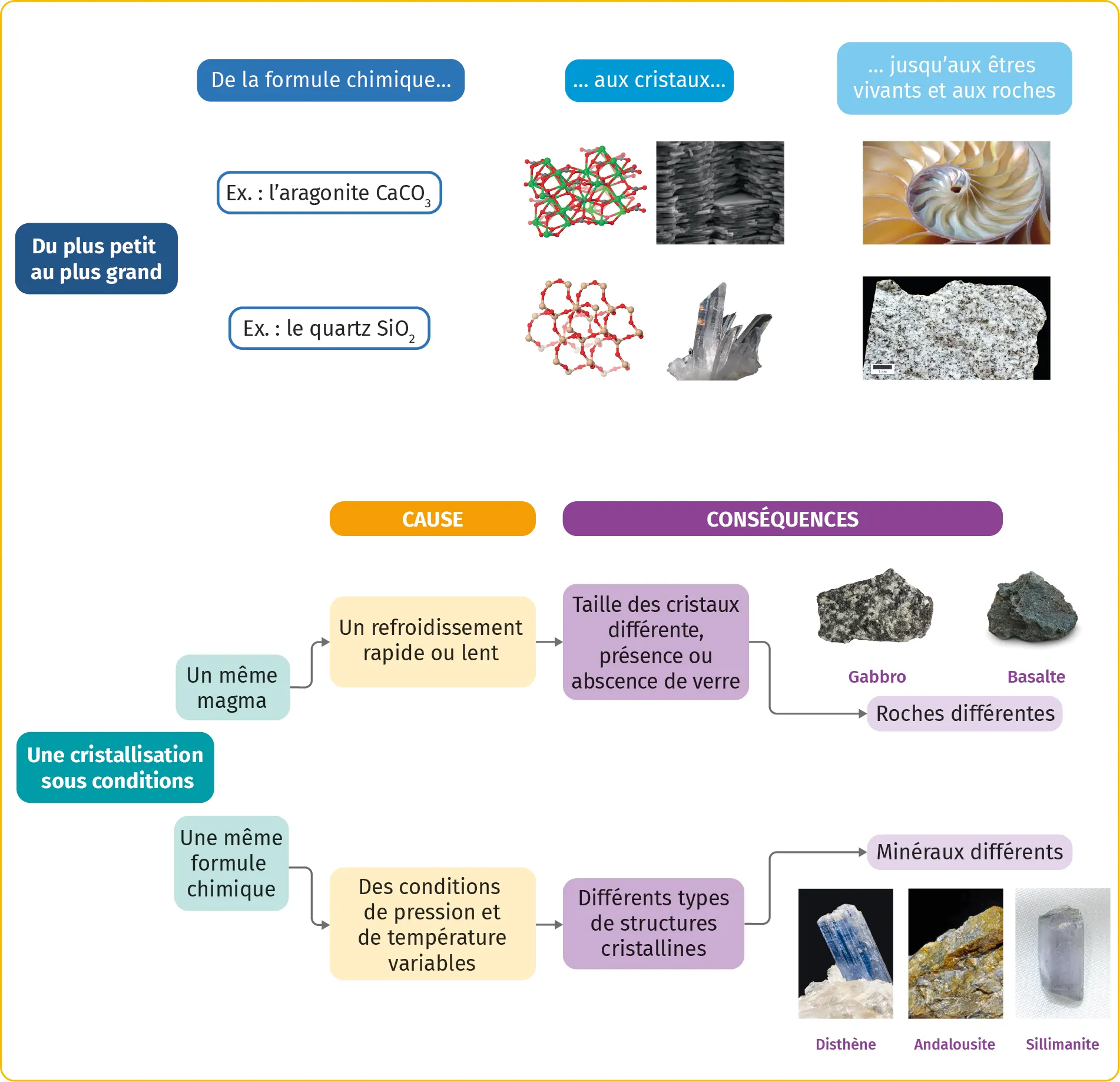
2Des roches aux êtres vivants: les cristaux sont partout!
- Caractérisés par une formule chimique, les minéraux s'organisent dans l'espace sous forme de cristaux. Ces cristaux sont la plus petite structure organisée qui compose généralement les roches.
- Dans de nombreux cas, les cristaux font également partie intégrante de la structure des êtres vivants (coquille, squelette, calcul rénal, émail des dents, etc.).
- La connaissance de la structure et du mode de formation des cristaux du vivant permet d'envisager des traitements médicaux.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
3Les conditions de formation des cristaux
- L'agencement des atomes qui forment les cristaux dépend des conditions de pression et de température. Un même composé de formule chimique unique pourra donc cristalliser dans différents systèmes cristallins.
- Dans le cas des roches formées par solidification d'un magma, la vitesse de refroidissement influence la formation des cristaux. Le refroidissement rapide d'un magma conduit à une cristallisation partielle. Il se forme alors des petits cristaux dispersés dans du verre, solide amorphe ne présentant pas d'organisation cristalline. En revanche, le refroidissement lent d'un magma permet la formation de gros cristaux jointifs.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
On se limite ici à un cas idéal, c'est-à-dire aux solides cristallins dont l'organisation est supposée parfaitement régulière. Un cristal présente en réalité de nombreux défauts.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Cristal : solide constitué d'entités chimiques arrangées de
manière régulière.
Magma : roche entièrement ou partiellement fondue.
Maille : volume élémentaire qui se répète au sein d'un cristal. La structure de la maille impose les propriétés physicochimiques du cristal à l'échelle macroscopique.
Masse volumique : rapport entre la masse et le volume d'un échantillon.
Minéral : espèce chimique naturelle se présentant sous forme de solide à structure cristalline.
Roche : matériau composé d'un assemblage de minéraux, cristallins ou vitreux.
Solide amorphe : solide constitué d'entités chimiques dont l'arrangement est désordonné, contrairement au solide cristallin.
Solide cristallin : solide constitué d'une répétition quasi parfaite de l'arrangement des atomes dans les trois directions de l'espace, contrairement au solide amorphe.
Verre : solide amorphe formé par refroidissement très rapide d'un magma.
Magma : roche entièrement ou partiellement fondue.
Maille : volume élémentaire qui se répète au sein d'un cristal. La structure de la maille impose les propriétés physicochimiques du cristal à l'échelle macroscopique.
Masse volumique : rapport entre la masse et le volume d'un échantillon.
Minéral : espèce chimique naturelle se présentant sous forme de solide à structure cristalline.
Roche : matériau composé d'un assemblage de minéraux, cristallins ou vitreux.
Solide amorphe : solide constitué d'entités chimiques dont l'arrangement est désordonné, contrairement au solide cristallin.
Solide cristallin : solide constitué d'une répétition quasi parfaite de l'arrangement des atomes dans les trois directions de l'espace, contrairement au solide amorphe.
Verre : solide amorphe formé par refroidissement très rapide d'un magma.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Certaines bactéries, dites magnétotactiques, forment des cristaux intracellulaires de magnétite (un oxyde de fer). Ceux-ci possèdent des propriétés magnétiques, permettant à ces bactéries de percevoir la direction du champ magnétique terrestre et de s'orienter par rapport à la direction de ce champ.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
La chrysotile \mathrm{Mg}_3 \mathrm{Si}_2 \mathrm{O}_5(\mathrm{OH})_4, bien plus connu sous le nom d'amiante, est un silicate de magnésium (ou éventuellement de calcium) qui cristallise en formant de fines fibres. Présentant des propriétés très intéressantes, comme sa capacité à isoler thermiquement ou à protéger contre le feu, l'amiante a été massivement employée au cours du XXe siècle dans le secteur du bâtiment notamment. Néanmoins, ce matériau est toxique et libère des fibres dans l'air provoquant l'apparition de divers cancers par inhalation. Il est interdit en France depuis 1997.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
De la structure cristalline à la masse volumique
La maille du chlorure de sodium \mathrm{NaCl} est schématisée ci-contre :
- Elle nous permet d'extraire des données comme le nombre d'ions chlorure \mathrm{Cl}^{-}(c'est-à-dire 4) et d'ions sodium \mathrm{Na}^{+}(également 4) dans cette maille.
- Ce nombre étant connu, avec les données de la masse des ions et du paramètre de la maille a, on peut calculer la masse volumique de l'espèce étudiée grâce à :
\rho=\frac{m_{\text {entités }}}{V_{\text {maille }}}

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
De la structure cristalline à la masse volumique

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Visionnez une explication sur des édifices ordonnés : les cristaux
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
