Physique-Chimie 1re Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Composition chimique d'un système
Ch. 2
Composition chimique des solutions
Ch. 3
Évolution d'un système chimique
Ch. 4
Réactions d'oxydoréduction
Ch. 5
Détermination d'une quantité de matière par titrage
Livret Bac : Thème 1
Ch. 6
De la structure à la polarité d'une entité
Ch. 7
Interpréter les propriétés d’une espèce chimique
Ch. 8
Structure des entités organiques
Ch. 9
Synthèse d'espèces chimiques organiques
Ch. 10
Conversions d'énergie au cours d'une combustion
Livret Bac : Thème 1 bis
2. Mouvement et interactions
Ch. 11
Modélisation d'interactions fondamentales
Ch. 12
Description d'un fluide au repos
Ch. 13
Mouvement d'un système
Livret Bac : Thème 2
3. L'énergie, conversions et transferts
Ch. 14
Études énergétiques en électricité
Ch. 15
Études énergétiques en mécanique
Livret Bac : Thème 3
4. Ondes et signaux
Ch. 16
Ondes mécaniques
Ch. 17
Images et couleurs
Ch. 18
Modèles ondulatoire et particulaire de la lumière
Livret Bac : Thème 4
Méthode
Fiches méthode
Fiche méthode compétences
Annexes
Chapitre 4
Cours
Réactions d'oxydoréduction
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
1Notion d'oxydation et de réduction
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Description
Une réaction d'oxydoréduction consiste en un transfert d'électrons
entre deux espèces chimiques.
Elle met en jeu à la fois une oxydation (perte d'électrons) et une réduction (gain d'électrons).
Remarque : Le terme d'oxydation désignait à l'origine la corrosion d'une espèce chimique par le dioxygène. Aujourd'hui, ce n'est pas forcément le cas, une réaction d'oxydation ne fait pas forcément intervenir l'élément oxygène.
Elle met en jeu à la fois une oxydation (perte d'électrons) et une réduction (gain d'électrons).
Remarque : Le terme d'oxydation désignait à l'origine la corrosion d'une espèce chimique par le dioxygène. Aujourd'hui, ce n'est pas forcément le cas, une réaction d'oxydation ne fait pas forcément intervenir l'élément oxygène.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Oxydoréduction : réaction chimique entre l'oxydant d'un couple et le réducteur d'un autre couple redox.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
BOxydant et réducteur
Un oxydant est une espèce chimique capable de gagner un ou plusieurs électrons.
Un gain d'électrons s'appelle une réduction.
Un oxydant qui se réduit devient un réducteur.
Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons.
Une perte d'électrons s'appelle une oxydation.
Un réducteur qui s'oxyde devient un oxydant.
La réaction d'oxydoréduction est donc un transfert d'électrons du réducteur vers l'oxydant.
Un gain d'électrons s'appelle une réduction.
Un oxydant qui se réduit devient un réducteur.
Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons.
Une perte d'électrons s'appelle une oxydation.
Un réducteur qui s'oxyde devient un oxydant.
La réaction d'oxydoréduction est donc un transfert d'électrons du réducteur vers l'oxydant.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1Combustion du fer


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C Couple redox et demi-équation
Au cours d'une réaction d'oxydoréduction, un oxydant peut être
réduit en une espèce chimique qui est son conjugué.
Deux espèces conjuguées forment un couple Ox/Red si elles peuvent être reliées par une demi-équation de la forme :
Exemple : la pile Daniell (doc. 3)
Le réducteur zinc \text{Zn}, qui est oxydé, devient l'ion \text{Zn}^{2+}.
L'oxydant \text{Cu}^{2+}, qui est réduit, devient du cuivre métallique \text{Cu}.
Cette réaction d'oxydoréduction fait donc intervenir les 2 couples redox \text{Cu}^{2+}(\text{aq})/\text{Cu}(\text{s}) et \text{Zn}^{2+}(\text{aq})/\text{Zn}(\text{s}).
Par convention, les couples oxydant-réducteur s'écrivent toujours de la même manière : l'oxydant à gauche et le réducteur à droite. On les note sous la forme Ox/Red.
Remarque : Par simplification, on utilise parfois le terme redox à la place d'oxydoréduction.
Deux espèces conjuguées forment un couple Ox/Red si elles peuvent être reliées par une demi-équation de la forme :
Ox + n \text{e}^{-} = Red (doc. 2).
Exemple : la pile Daniell (doc. 3)
Le réducteur zinc \text{Zn}, qui est oxydé, devient l'ion \text{Zn}^{2+}.
L'oxydant \text{Cu}^{2+}, qui est réduit, devient du cuivre métallique \text{Cu}.
Cette réaction d'oxydoréduction fait donc intervenir les 2 couples redox \text{Cu}^{2+}(\text{aq})/\text{Cu}(\text{s}) et \text{Zn}^{2+}(\text{aq})/\text{Zn}(\text{s}).
Par convention, les couples oxydant-réducteur s'écrivent toujours de la même manière : l'oxydant à gauche et le réducteur à droite. On les note sous la forme Ox/Red.
Remarque : Par simplification, on utilise parfois le terme redox à la place d'oxydoréduction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2Quelques repères
Au sein du couple Ox/Red, l'oxydant Ox et le réducteur Red sont reliés par demi-équation électronique :
Ox + n \text{e}^{-} = Red
- Ox capte n électrons \text{e}^{-} et subit une réduction.
- Red cède n électrons \text{e}^{-} et subit une oxydation.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
➜ Une espèce chimique peut être un oxydant dans un
couple et un réducteur dans un autre.
Par exemple, l'ion fer II est l'oxydant dans le couple \text{Fe}^{2+}(\text{aq})/\text{Fe}(\text{s}) et le réducteur dans le couple \text{Fe}^{3+}(\text{aq})/\text{Fe}^{2+}(\text{aq}).
Par exemple, l'ion fer II est l'oxydant dans le couple \text{Fe}^{2+}(\text{aq})/\text{Fe}(\text{s}) et le réducteur dans le couple \text{Fe}^{3+}(\text{aq})/\text{Fe}^{2+}(\text{aq}).
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 3Une pile zinc/cuivre


Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
2Équations et demi-équations
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
A Ajustement des demi-équations
Certaines demi-équations font intervenir des molécules d'eau et
des ions hydrogène \text{H}^{+}.
1. ajustement des éléments autres que l'oxygène et l'hydrogène ;
2. ajustement de l'élément oxygène à l'aide de \text{H}_{2}\text{O} ;
3. ajustement de l'élément hydrogène à l'aide des ions \text{H}^{+} ;
4. ajustement des charges à l'aide des électrons \text{e}^{-}.
Exemple : réduction des ions \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-} en ions \mathrm{Cr}^{3+}.
1. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}=\:\mathrm{Cr}^{3+} \Rightarrow \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}=\color{red}2\: \color{noir}\mathrm{Cr}^{3+}.
2. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}=\:2\: \mathrm{Cr}^{3+}\color{red}+7 \:\mathrm{H}_{2} \mathrm{O}.
3. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}\color{red}+14\:\mathrm{H}^{+}\color{noir}=2\:\mathrm{Cr}^{3+}+7\: \mathrm{H}_{2} \mathrm{O}.
4. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}+14\: \mathrm{H}^{+}\color{red}+6\: \mathrm{e}^{-}\color{noir}=2\: \mathrm{Cr}^{3+}+7\: \mathrm{H}_{2} \mathrm{O}.
1. ajustement des éléments autres que l'oxygène et l'hydrogène ;
2. ajustement de l'élément oxygène à l'aide de \text{H}_{2}\text{O} ;
3. ajustement de l'élément hydrogène à l'aide des ions \text{H}^{+} ;
4. ajustement des charges à l'aide des électrons \text{e}^{-}.
Exemple : réduction des ions \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-} en ions \mathrm{Cr}^{3+}.
1. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}=\:\mathrm{Cr}^{3+} \Rightarrow \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}=\color{red}2\: \color{noir}\mathrm{Cr}^{3+}.
2. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}=\:2\: \mathrm{Cr}^{3+}\color{red}+7 \:\mathrm{H}_{2} \mathrm{O}.
3. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}\color{red}+14\:\mathrm{H}^{+}\color{noir}=2\:\mathrm{Cr}^{3+}+7\: \mathrm{H}_{2} \mathrm{O}.
4. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}+14\: \mathrm{H}^{+}\color{red}+6\: \mathrm{e}^{-}\color{noir}=2\: \mathrm{Cr}^{3+}+7\: \mathrm{H}_{2} \mathrm{O}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Demi-équation : équation bilan montrant le transfert d'électrons dans un couple redox.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
➜
Par convention, les demi-équations doivent toujours
être écrites avec des signes «~+~ ».
Ainsi, l'oxydation du fer solide en ions fer (II) s'écrit \text{Fe}(\mathrm{s})=\text{Fe}^{2+}(\text{aq})+2\:\mathrm{e}^{-} et non pas \text{Fe}(\text{s})-2\: \mathrm{e}^{-}=\text{Fe}^{2+}(\text{aq}).
➜ On utilise toujours le signe = pour les demi-équations et le signe → pour une équation bilan d'oxydoréduction.
Ainsi, l'oxydation du fer solide en ions fer (II) s'écrit \text{Fe}(\mathrm{s})=\text{Fe}^{2+}(\text{aq})+2\:\mathrm{e}^{-} et non pas \text{Fe}(\text{s})-2\: \mathrm{e}^{-}=\text{Fe}^{2+}(\text{aq}).
➜ On utilise toujours le signe = pour les demi-équations et le signe → pour une équation bilan d'oxydoréduction.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
B Demi-équations en milieu basique
Pour ajuster les demi-équations en milieu basique (ions hydroxyde majoritaires par rapport aux ions hydrogène \text{H}^{+}), on ajoute autant
d'ions \text{HO}^{-} de part et d'autre de l'équation qu'il y a d'ions \text{H}^{+}. Ces deux derniers ions se combinent pour former une molécule d'eau. On élimine ensuite autant de molécules d'eau qu'il y en a présentes des deux côtés de la demi-équation.
Exemple : On ajuste la demi-équation suivante en milieu basique :
1. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}+14\: \mathrm{H}^{+}+14\: \mathrm{HO}^{-}+6\: \mathrm{e}^{-}=2\: \mathrm{Cr}^{3+}+7\: \mathrm{H}_{2} \mathrm{O}+14\: \mathrm{HO}^{-}.
2. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}+14\: \mathrm{H}_{2} \mathrm{O}+6\: \mathrm{e}^{-}=2\: \mathrm{Cr}^{3+}+7\: \mathrm{H}_{2} \mathrm{O}+14\: \mathrm{HO}^{-}.
3. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}+7\: \mathrm{H}_{2} \mathrm{O}+6\: \mathrm{e}^{-}=2\: \mathrm{Cr}^{3+}+14\: \mathrm{HO}^{-}.
Exemple : On ajuste la demi-équation suivante en milieu basique :
1. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}+14\: \mathrm{H}^{+}+14\: \mathrm{HO}^{-}+6\: \mathrm{e}^{-}=2\: \mathrm{Cr}^{3+}+7\: \mathrm{H}_{2} \mathrm{O}+14\: \mathrm{HO}^{-}.
2. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}+14\: \mathrm{H}_{2} \mathrm{O}+6\: \mathrm{e}^{-}=2\: \mathrm{Cr}^{3+}+7\: \mathrm{H}_{2} \mathrm{O}+14\: \mathrm{HO}^{-}.
3. \mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}+7\: \mathrm{H}_{2} \mathrm{O}+6\: \mathrm{e}^{-}=2\: \mathrm{Cr}^{3+}+14\: \mathrm{HO}^{-}.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
➜ Un mélange entre un oxydant et un réducteur ne va pas toujours donner lieu à une transformation chimique. Pour déterminer les oxydants qui réagissent spontanément avec des réducteurs, il existe une échelle de potentiels. Cette échelle est construite en mesurant la tension aux bornes de différentes piles, mais cette démarche n'est pas au programme en première.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
C Écriture de l'équation bilan
Après avoir déterminé les couples mis en jeu dans la réaction d'oxydoréduction et équilibré les demi-équations, on peut écrire l'équation bilan. Celle-ci consiste en une combinaison des deux demi-équations que l'on ajuste de telle sorte que les électrons n'apparaissent pas dans l'équation bilan.
Pour cela, les demi-équations utilisées doivent faire intervenir le même nombre d'électrons. Dans ces conditions, on peut être amené à multiplier par un même nombre tous les coefficients stoechiométriques de chaque demi-équation avant de les additionner.
Exemple : pour les couples \mathrm{Al}^{3+}(\mathrm{aq}) / \mathrm{Al}(\mathrm{s}) et \mathrm{Cu}^{2+}(\mathrm{aq}) / \mathrm{Cu}(\mathrm{s}), on écrit :

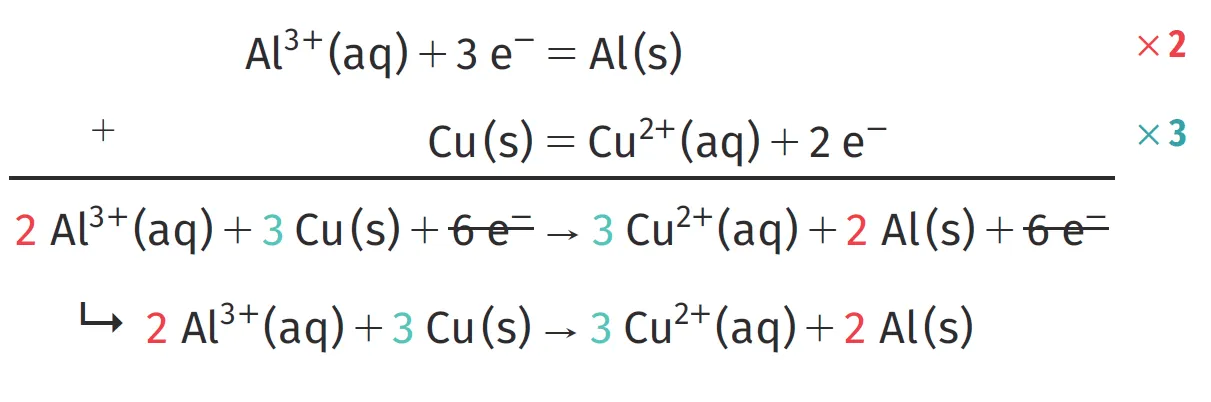
Pour cela, les demi-équations utilisées doivent faire intervenir le même nombre d'électrons. Dans ces conditions, on peut être amené à multiplier par un même nombre tous les coefficients stoechiométriques de chaque demi-équation avant de les additionner.
Exemple : pour les couples \mathrm{Al}^{3+}(\mathrm{aq}) / \mathrm{Al}(\mathrm{s}) et \mathrm{Cu}^{2+}(\mathrm{aq}) / \mathrm{Cu}(\mathrm{s}), on écrit :

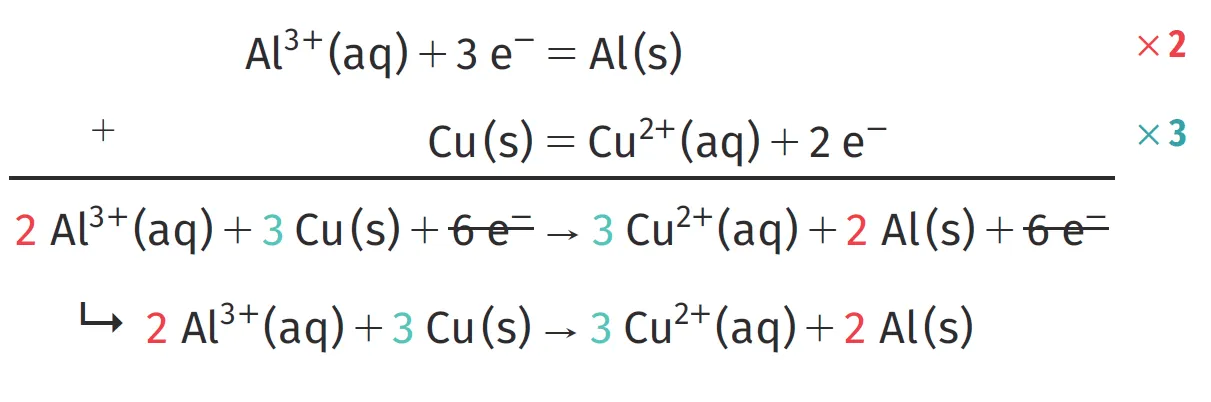
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4Oxydoréduction


L'aluminothermie est une réaction d'oxydoréduction entre l'aluminium et certains oxydes métalliques.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Retrouvez de rappel sur l'équilibrage d'une réaction chimique.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
