Physique-Chimie 1re Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Composition chimique d'un système
Ch. 2
Composition chimique des solutions
Ch. 3
Évolution d'un système chimique
Ch. 4
Réactions d'oxydoréduction
Ch. 5
Détermination d'une quantité de matière par titrage
Livret Bac : Thème 1
Ch. 6
De la structure à la polarité d'une entité
Ch. 7
Interpréter les propriétés d’une espèce chimique
Ch. 8
Structure des entités organiques
Ch. 9
Synthèse d'espèces chimiques organiques
Ch. 10
Conversions d'énergie au cours d'une combustion
Livret Bac : Thème 1 bis
2. Mouvement et interactions
Ch. 11
Modélisation d'interactions fondamentales
Ch. 12
Description d'un fluide au repos
Ch. 13
Mouvement d'un système
Livret Bac : Thème 2
3. L'énergie, conversions et transferts
Ch. 14
Études énergétiques en électricité
Ch. 15
Études énergétiques en mécanique
Livret Bac : Thème 3
4. Ondes et signaux
Ch. 16
Ondes mécaniques
Ch. 17
Images et couleurs
Ch. 18
Modèles ondulatoire et particulaire de la lumière
Livret Bac : Thème 4
Méthode
Fiches méthode
Fiche méthode compétences
Annexes
Chapitre 6
Exercices
Pour aller plus loin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34 Le serpent qui se mord la queue
✔ APP : Extraire l'information utile1. À partir des documents, donner la formule brute du benzène puis établir sa représentation de Lewis.
Cliquez pour accéder à une zone de dessin
2. Cette représentation respecte-t-elle les hypothèses établies en chimie par Kekulé ?
3. Quelle est la géométrie observée autour des atomes de carbone de cette molécule ?
4. Le benzène a longtemps été utilisé comme solvant mais son usage est désormais très encadré en raison de sa toxicité. Ce solvant est-il polaire ou apolaire ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
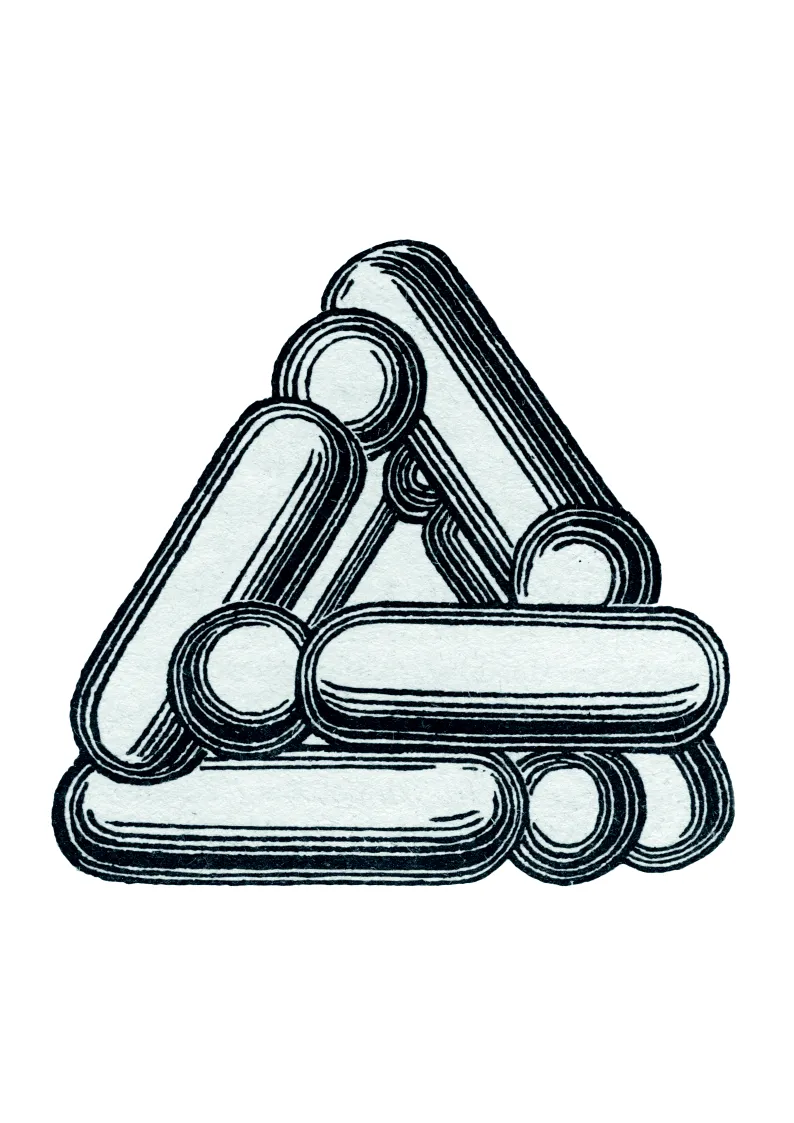
Doc. 3
Structure spatiale du benzène selon Kekulé

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 5
L'ouroboros


L'ouroboros est un dessin ou un objet représentant un serpent ou un dragon qui se mord la queue. Il s'agit
d'un mot grec latinisé sous la forme uroborus qui signifie littéralement « qui se mord la queue ».
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Comment Kekulé eut l'idée de passer de la formule brute du benzène à la structure de la molécule ?
Visionnez cette pour avoir plus d'informations.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 1
Le benzène et les travaux de Kekulé

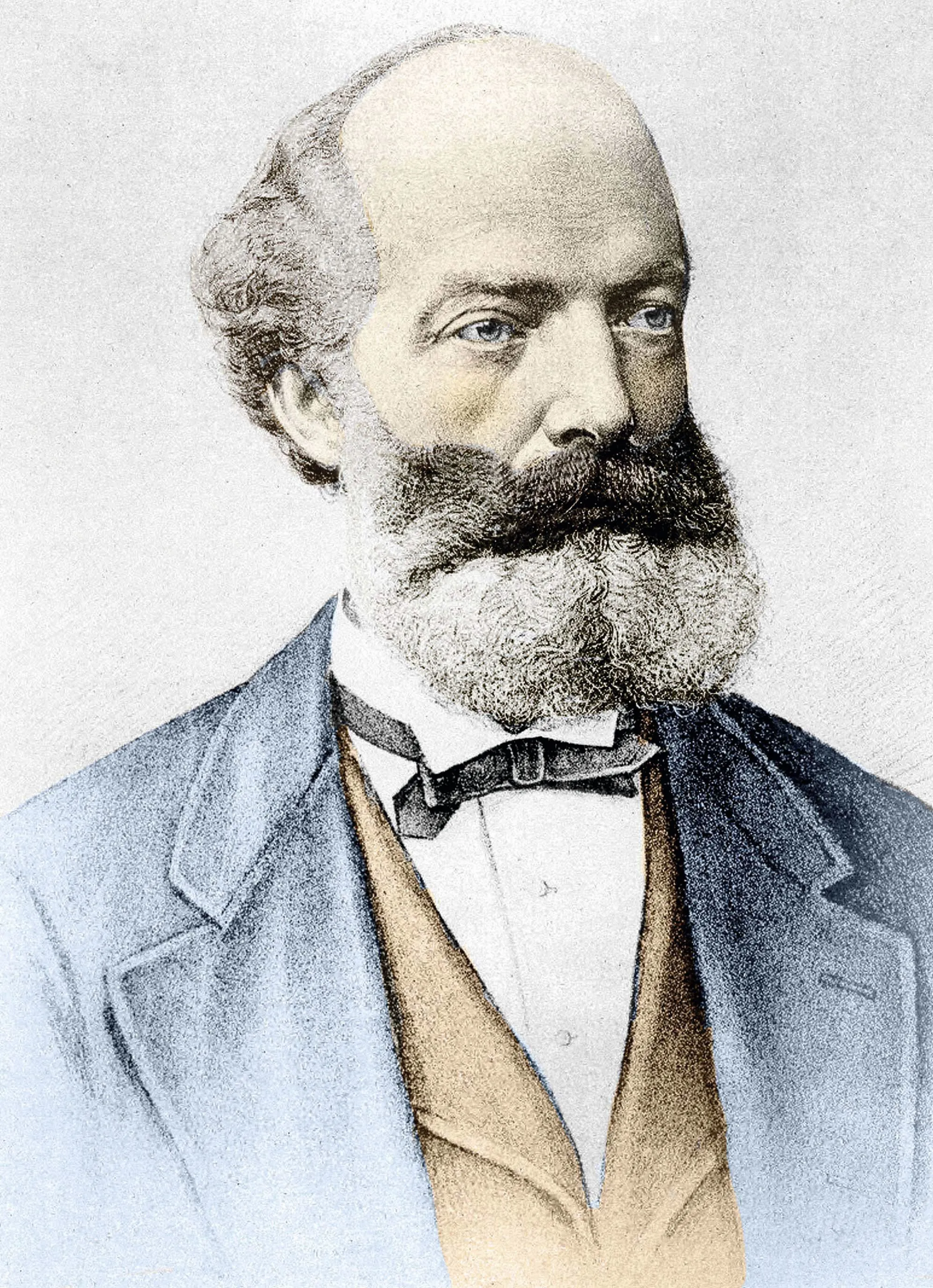
Friedrich August Kekulé von Stradonitz (1829-1896) est un chimiste organicien allemand célèbre pour ses travaux sur la tétravalence du carbone et sur la formule développée du benzène.
En 1858, Kekulé émet deux hypothèses :
- le carbone est toujours tétravalent ;
- les composés organiques sont des enchaînements d'atomes de carbone, ayant échangé entre eux, une ou plusieurs unités de saturation (c'est ainsi qu'il nomme les liaisons simples voire doubles).
En 1865, il travaille sur la formule développée du benzène de formule brute \mathrm{C}_{6} \mathrm{H}_{6}. Aucune des formules auxquelles il songe, linéaire ou ramifiée, ne correspond parfaitement avec la monovalence de l'hydrogène \mathrm{H} et surtout la tétravalence du carbone \mathrm{C}.
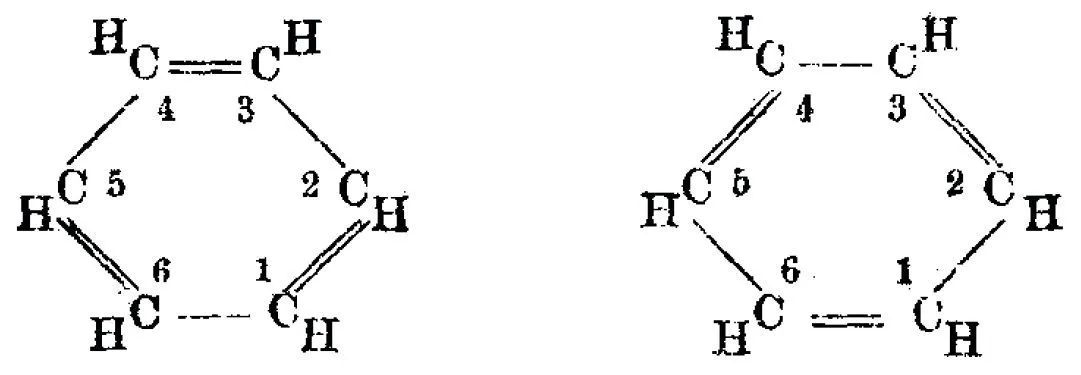
Il propose fi nalement une structure cyclique, la première dans l'histoire de la chimie, avec un cycle de six atomes de carbone liés par des liaisons simples et doubles en alternance.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 2
La structure cyclique du benzène proposée par Kekulé

Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
- Numéro atomique des atomes :
\mathrm{C} (Z=6) ;
\mathrm{H} (Z=1). - Électronégativité \chi des atomes :
\chi(\mathrm{C}) =2\text{,}55 ;
\chi(\mathrm{H}) =2\text{,}20.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 4
Le rêve de Kekulé
Kekulé raconte que sa théorie a été créée lorsqu'une nuit, il rêve de l'ouroboros : « Je tournais ma chaise vers le feu et tombais dans un demi-sommeil. De nouveau, les atomes s'agitèrent devant mes yeux [...] De longues chaînes, souvent associées de façon plus serrée, étaient toutes en mouvement, s'entrelaçant et se tortillant comme des serpents. Mais attention, qu'était-ce que cela ? Un des serpents avait saisi sa propre queue, et cette forme tournoyait de façon moqueuse devant mes yeux. Je m'éveillai en un éclair. »
Et de conclure : « Apprenons à rêver, mais gardons-nous de rendre publics nos rêves avant qu'ils n'aient été mis à l'épreuve par notre esprit bien éveillé. » Les historiens débattent encore sur la vérité de cette histoire : certains croient que Kekulé l'aurait inventée quand il l'a racontée en 1890.
Et de conclure : « Apprenons à rêver, mais gardons-nous de rendre publics nos rêves avant qu'ils n'aient été mis à l'épreuve par notre esprit bien éveillé. » Les historiens débattent encore sur la vérité de cette histoire : certains croient que Kekulé l'aurait inventée quand il l'a racontée en 1890.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
Doc. 6
Une nouvelle description du benzène


Au début des années 1930, la meilleure description de la structure du benzène restait celle du chimiste Friedrich August Kekulé, à savoir la transition rapide entre deux structures dans lesquelles les liaisons simples et doubles seraient alternées, les liaisons simples venant prendre la place des doubles et réciproquement.
Linus Pauling montre qu'une description intermédiaire entre les deux structures, basée sur la mécanique quantique, est plus pertinente : il s'agit de la superposition de ces deux structures. Ce phénomène sera plus tard baptisé du nom de résonance.
Linus Pauling montre qu'une description intermédiaire entre les deux structures, basée sur la mécanique quantique, est plus pertinente : il s'agit de la superposition de ces deux structures. Ce phénomène sera plus tard baptisé du nom de résonance.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
35 Limitation du modèle VSEPR et avènement de la mécanique quantique
✔ RAI/ANA : Construire un raisonnement
La méthode VSEPR est adoptée pour décrire la géométrie de molécules simples possédant un seul atome central. Cependant, pour des molécules plus complexes, avec plusieurs atomes centraux liés les uns aux autres, la théorie VSEPR se retrouve mise en échec.
Un exemple classique de cette limite est la molécule d'éthène \mathrm{C}_{2} \mathrm{H}_{4}. Les mesures expérimentales montrent que tous les atomes de cette molécule sont dans un même plan. Dans une molécule possédant deux atomes centraux, il est possible de représenter les liaisons de chaque atome central par rapport à un plan. Dans la figure de gauche, les deux plans comprenant les liaisons de chaque atome central sont parallèles. Dans la figure de droite, les deux plans comprenant les liaisons de chaque atome central sont perpendiculaires.
Un exemple classique de cette limite est la molécule d'éthène \mathrm{C}_{2} \mathrm{H}_{4}. Les mesures expérimentales montrent que tous les atomes de cette molécule sont dans un même plan. Dans une molécule possédant deux atomes centraux, il est possible de représenter les liaisons de chaque atome central par rapport à un plan. Dans la figure de gauche, les deux plans comprenant les liaisons de chaque atome central sont parallèles. Dans la figure de droite, les deux plans comprenant les liaisons de chaque atome central sont perpendiculaires.

1.
Représenter la formule de Lewis de l'éthène en numérotant avec les indices 1 et 2 les deux atomes de carbone.
2. Combien d'atomes centraux possèdent la molécule ? Quels sont ces atomes ?
3. Donner la géométrie observée pour chaque atome central.
Cliquez pour accéder à une zone de dessin
2. Combien d'atomes centraux possèdent la molécule ? Quels sont ces atomes ?
3. Donner la géométrie observée pour chaque atome central.
4.
À partir des observations ci-dessus, proposer une explication sur les limites du modèle VSEPR.
Histoire des sciences
La mécanique quantique permet d'étudier la position ou le mouvement des électrons et de définir
notamment le modèle des orbitales moléculaires. Ces orbitales moléculaires sont constituées d'orbitales
atomiques qui délimitent une zone de l'espace dans laquelle les électrons sont susceptibles de se
trouver autour de chaque atome. Ainsi, les orbitales atomiques ayant des formes régies par la mécanique
quantique, les liaisons que peut former un atome sont limitées, ce qui contraint la géométrie des
molécules. On doit à Linus Pauling la plupart des connaissances dans ce domaine particulier qu'est la
chimie quantique.
Linus Pauling a commencé à publier ses travaux sur la nature de la liaison chimique au début des années 1930, ces travaux aboutissent en 1939 avec The Nature of the Chemical Bond. Ce livre est l'un des plus importants livres de chimie publiés. Linus Pauling reçoit le prix Nobel de chimie en 1954 puis un prix Nobel de la paix en 1962 pour son engagement pacifiste sur le nucléaire.
Linus Pauling a commencé à publier ses travaux sur la nature de la liaison chimique au début des années 1930, ces travaux aboutissent en 1939 avec The Nature of the Chemical Bond. Ce livre est l'un des plus importants livres de chimie publiés. Linus Pauling reçoit le prix Nobel de chimie en 1954 puis un prix Nobel de la paix en 1962 pour son engagement pacifiste sur le nucléaire.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
36Bac La molécule de l'ADN
✔ RAI/MOD : Respecter les conventions en chimie
Les deux brins de la structure d'ADN s'enroulent l'un autour de l'autre pour former la fameuse double hélice
de l'ADN.
Cette structure en double hélice est particulièrement stable grâce à la création de liaisons hydrogène entre les bases nucléiques qui se font face sur chaque brin. L'interaction entre ces molécules peut être symbolisée de manière simplifiée par une liaison hydrogène entre les molécules de \mathrm{CH}_{2} \mathrm{O} et \mathrm{NH}_{3} et entre les molécules \mathrm{NH}_{3} et \mathrm{HNCH}_{2}.
Cette structure en double hélice est particulièrement stable grâce à la création de liaisons hydrogène entre les bases nucléiques qui se font face sur chaque brin. L'interaction entre ces molécules peut être symbolisée de manière simplifiée par une liaison hydrogène entre les molécules de \mathrm{CH}_{2} \mathrm{O} et \mathrm{NH}_{3} et entre les molécules \mathrm{NH}_{3} et \mathrm{HNCH}_{2}.
1.
Établir les formules de Lewis de \mathrm{CH}_{2} \mathrm{O} et \mathrm{HNCH}_{2}.
2. Quelle est la géométrie de ces deux molécules ?
Cliquez pour accéder à une zone de dessin
2. Quelle est la géométrie de ces deux molécules ?
3.
Proposer une formule de Lewis pour la molécule de \mathrm{HNCH}_{2}.
4. Proposer la géométrie de cette molécule en considérant l'atome d'azote comme étant l'atome central.
Cliquez pour accéder à une zone de dessin
4. Proposer la géométrie de cette molécule en considérant l'atome d'azote comme étant l'atome central.
Remarque
Pour aller plus loin, faire l'exercice
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.


En 1951, Linus Pauling et ses collègues proposent l'hélice a et le feuillet b comme motifs structuraux
principaux de la structure des protéines. Linus Pauling propose une structure hélicoïdale pour l'ADN basée sur ses découvertes précédentes mais il commet quelques erreurs dans la description de cette structure. Lorsque William Lawrence Bragg, en compétition avec Linus Pauling, apprend que ce dernier travaille sur la structure de molécule d'ADN, il autorise James Dewey Watson et Francis Crick à proposer un modèle de l'ADN en utilisant des travaux non publiés de Maurice Wilkins et Rosalind Franklin du King's College de Londres.
En 1953, Watson et Crick proposent une structure correcte pour la double hélice d'ADN, ce qui leur vaudra le prix Nobel de physiologie ou médecine en 1962… et cela au détriment de Rosalind Franklin dont ils ne citent jamais les travaux qui leur ont permis de proposer une structure correcte !
En 1953, Watson et Crick proposent une structure correcte pour la double hélice d'ADN, ce qui leur vaudra le prix Nobel de physiologie ou médecine en 1962… et cela au détriment de Rosalind Franklin dont ils ne citent jamais les travaux qui leur ont permis de proposer une structure correcte !
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
