Physique-Chimie 1re Spécialité
Rejoignez la communauté !
Co-construisez les ressources dont vous avez besoin et partagez votre expertise pédagogique.
Mes Pages
1. Constitution et transformations de la matière
Ch. 1
Composition chimique d'un système
Ch. 2
Composition chimique des solutions
Ch. 3
Évolution d'un système chimique
Ch. 4
Réactions d'oxydoréduction
Ch. 5
Détermination d'une quantité de matière par titrage
Livret Bac : Thème 1
Ch. 6
De la structure à la polarité d'une entité
Ch. 7
Interpréter les propriétés d’une espèce chimique
Ch. 8
Structure des entités organiques
Ch. 9
Synthèse d'espèces chimiques organiques
Ch. 10
Conversions d'énergie au cours d'une combustion
Livret Bac : Thème 1 bis
2. Mouvement et interactions
Ch. 11
Modélisation d'interactions fondamentales
Ch. 12
Description d'un fluide au repos
Ch. 13
Mouvement d'un système
Livret Bac : Thème 2
3. L'énergie, conversions et transferts
Ch. 14
Études énergétiques en électricité
Ch. 15
Études énergétiques en mécanique
Livret Bac : Thème 3
4. Ondes et signaux
Ch. 16
Ondes mécaniques
Ch. 17
Images et couleurs
Ch. 18
Modèles ondulatoire et particulaire de la lumière
Livret Bac : Thème 4
Méthode
Fiches méthode
Fiche méthode compétences
Annexes
Chapitre 12
Exercices
Pour aller plus loin
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
32 L'expérience de Torricelli et ses conséquences
✔ RAI/MOD : Faire le bilan des forces✔ RAI/ANA : Faire le lien entre les modèles microscopiques et les grandeurs macroscopiques

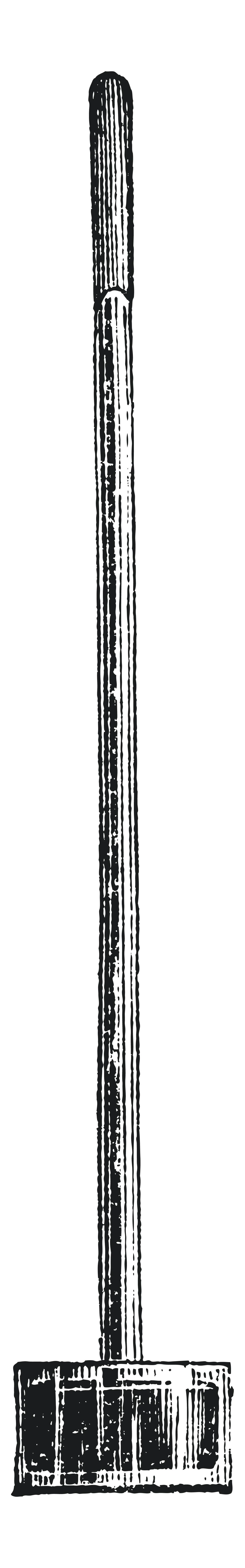
En 1644, Torricelli (1608-1647) réalise une expérience : il place sur un bain de mercure un tube rempli lui aussi de mercure, avec l'ouverture vers le bas. Quelle que soit la hauteur du tube ou son inclinaison, le mercure s'en écoule jusqu'à ce que le ménisque atteigne 76 cm au-dessus du bain.
1. Pourquoi le mercure s'écoule-t-il ?
2. Que contient le tube au-dessus du mercure ?
En 1648, Blaise Pascal fait l'expérience à Clermont-Ferrand où il obtient les mêmes résultats. Au sommet du puy de Dôme, en revanche, le niveau du Mercure descend en dessous de 76 cm.
3. Pourquoi le niveau de mercure est-il plus faible au sommet du puy de Dôme ?
2. Que contient le tube au-dessus du mercure ?
En 1648, Blaise Pascal fait l'expérience à Clermont-Ferrand où il obtient les mêmes résultats. Au sommet du puy de Dôme, en revanche, le niveau du Mercure descend en dessous de 76 cm.
3. Pourquoi le niveau de mercure est-il plus faible au sommet du puy de Dôme ?
Histoire des sciences
Les conclusions que Blaise Pascal tire de l'expérience de 1648, dont l'existence du vide, restent controversées de son vivant. Des savants, en particulier René Descartes, s'y opposent.
L'existence du vide renvoie à d'autres débats comme l'existence des atomes et a longtemps été un sujet de controverse.
On peut en effet proposer d'autres interprétations pour cette expérience, notamment supposer que la gravité est moins intense en altitude. L'existence du vide est aujourd'hui établie.
L'existence du vide renvoie à d'autres débats comme l'existence des atomes et a longtemps été un sujet de controverse.
On peut en effet proposer d'autres interprétations pour cette expérience, notamment supposer que la gravité est moins intense en altitude. L'existence du vide est aujourd'hui établie.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
33Expérience à la maison
Bouchon de champagne
✔ RAI/MOD : Faire le bilan des forces✔ REA : Effectuer des calculs littéraux et numériques
Prendre une bouteille en plastique de 1,5 L vide. La boucher avec un bouchon en liège ou en silicone. Comprimer brutalement la bouteille. Le bouchon est projeté, éventuellement, à plusieurs mètres. (Attention : le bouchon peut faire des dégâts à l'impact).
1. Quelle loi s'applique ici ?
2. Expliquer cette expérience, en justifiant éventuellement par des schémas.
3. Un bouchon de champagne « saute » lorsque la pression à l'intérieur de la bouteille atteint environ 2,5 bars. Est-il plausible dans cette expérience que la pression atteigne de telles valeurs (1 bar = 105 Pa) ?
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
34Histoire des sciences
L'expérience de Mariotte
✔ REA : Effectuer des calculs littéraux et numériques✔ RAI/ANA : Élaborer/justifier un protocole

La loi de Mariotte a été découverte indépendamment par le Français Edme Mariotte (1620-1684) et par l'Irlandais Robert Boyle (1627-1691). Pour établir cette loi, Boyle utilise un tube en J dans lequel il verse un peu de mercure. L'air piégé dans le tube a alors une pression P_{0} et un volume V_{0}. Il ajoute ensuite du mercure dans le tube. Il mesure le nouveau volume d'air V_{1} et calcule la pression P_{1}.
1.
Comment peut-on calculer la pression P_{1} sans utiliser la loi de Mariotte ?
2.
Comment, à partir de plusieurs mesures de ce type, Boyle a-t-il pu établir la loi de Boyle-Mariotte ?
Données
- Volume d'air initial : V_{0}= 11 cm3 ;
- V_{1}= 7,0 cm3 ;
- h_{1}= 43,5 \times 10-2 m ;
- Masse volumique du mercure : \rho_m = 13{,}55 kg·dm‑3.
Ressource affichée de l'autre côté.
Faites défiler pour voir la suite.
Faites défiler pour voir la suite.
35 Des liquides au même niveau ?
✔ REA : Effectuer des calculs littéraux et numériques
Soit un tube en U rempli partiellement de mercure. On ajoute un volume d'eau d'un côté du tube, sur une hauteur h_{2} de 15 cm. L'eau et le mercure sont non miscibles.
1.
À votre avis, la surface libre de l'eau et celle du mercure sont-elles à la même hauteur (h_{1} = h_{2}) ? Pour le vérifier, il faut appliquer le principe fondamental de l'hydrostatique aux points 1 et 2, où la pression est identique.
2. Exprimer puis calculer h_{1}.
3. À quelle condition h_{1} et h_{2} ont-elles la même valeur ?
2. Exprimer puis calculer h_{1}.
3. À quelle condition h_{1} et h_{2} ont-elles la même valeur ?
Donnée
- Masse volumique du mercure : \rho_m = 13{,}55 kg·dm‑3.
Une erreur sur la page ? Une idée à proposer ?
Nos manuels sont collaboratifs, n'hésitez pas à nous en faire part.
j'ai une idée !
Oups, une coquille
